第二章 五、有序、无序和熵
自然界一切涉及热现象的宏观过程都是不可逆的,每一种宏观过程的不可逆性,都可以用来作为热力学第二定律的一种表述,所以热力学第二定律的表述方法是多种多样的。那么,能不能概括所有不可逆过程的共同本质,找出一个普遍的物理量作为共同的标准,判断各种不可逆过程的进行方向呢?
能量的耗散与退化
1852年,W.汤姆孙指出,在自然界发生的种种变化中,能量的总值虽然保持不变(守恒),但是能量可被利用的价值却越来越小,或者说能量的品质在逐步降级。这就是能量的耗散与退化。
对于人类来说,内能不如机械能、电能好用,它只能部分地用于做功,总有一部分内能要散发到温度较低的环境中。可见,内能是一种低品质的能,其他形式的能量通过摩擦、碰撞、燃烧等过程转换成内能,能量的品质就降低了。
由于宏观过程的不可逆性,一个系统的内能一旦增加,这个系统就永远无法依靠自身的作用(自发地)回到原先的状态,除非系统靠外界的帮助;而“外界的帮助”将更多地消耗其他形式的能量,产生出更多的内能来。
当我们使用地球上的能源时,并不会减少地球上的能量,而是将能源中高度有用的能量形式降低为不大可用的能量形式。例如,开汽车时要消耗汽油,把汽油中的化学能转变成内能,而汽车排气管排出的废气带走的内能就不能利用了。
思考与讨论
既然能量是守恒的,我们常说的“节约能源”又是什么意思?你能从日常生活中举出一些能量耗散与退化的例子吗?
绝对零度不可达到
我们在初中学过,宇宙中存在着温度的下限:-273.15℃。热力学温度,即绝对温度,就是以这个温度下限为起点的。热力学温度用丁表示,单位是开尔文(kelvin),符号是K。
热力学温度T与摄氏温度t(单位是℃)之间的换算关系是
T=t+273.15 K[1]
下表是我们已经知道的一些温度值。
|
事件 |
温度T/K |
|
氢弹爆炸中心 |
108 |
|
实验室获得的最高温度 |
6×107 |
|
太阳中心 |
1.5×107 |
|
地球中心 |
4×103 |
|
乙炔火焰 |
2.9×103 |
|
金的熔点 |
1337(1064℃) |
|
锡的熔点 |
505(232℃) |
|
月球的向阳面 |
400(127℃) |
|
地球上出现的最高温度(利比亚) |
331(58℃) |
|
地球上出现的最低温度(南极) |
185(-88℃) |
|
月球的背阴面 |
90(-183℃) |
|
氮的沸点 |
77 |
|
氦的沸点 |
4.2 |
|
星际空间 |
2.7 |
|
实验室已获得的最低温度 |
2.4×10-11 |
从这个表中我们看到,实验室获得的低温已经非常接近热力学零度(即绝对零度)。随着科学技术的发展,人们可以获得越来越低的温度。在低温世界单,许多物质的性质不同于常温下的性质,人们正在探索低温领域垦的物理现象。如何获得低温,是一项重要的研究课题。然而,人们发现,温度越低,降温越困难。对大量事实的研究分析表明,不可能通过有限的过程把物体冷却到绝对零度。这个结论也叫做热力学第三定律(third law of thermodynamics)。
尽管热力学零度不可能达到,但温度总可能降低。人们还在想办法尽可能接近热力学零度。
熵增加原理
1865年,克劳修斯分析了自然界自发过程的共同特征,引进了一个新的物理量熵(entropy)来表述能量耗散过程,通常用S表示。他证明了,只要有热从高温物体流向低温物体,或者只要做功产生了热,系统的熵值就要增大。更一般地说,由于自然界发生的任何过程中总会伴随着能量的耗散和退化,所以在一个热学系统发生的任何过程中,系统的熵都会增大。
这样,热力学第二定律又可以表述为:任何孤立系统,它的总熵永远不会减小;或者说,自然界的一切自发过程,总是朝着熵增加的方向进行的。这就是熵增加原理。
这里说的“孤立系统”,指的是与外界没有物质交换、热交换,与外界也没有力的相互作用、电磁相互作用的系统。这就排除了外界的影响,强调了过程的自发性。
“熵”这个概念是比较抽象的。克劳修斯指出,熵字本身就是“转变含量”的意思。一个系统的熵越大,就越接近平衡状态,就越是不易转化。所以,熵表示孤立系统内能量的耗散和退化的程度。熵增加原理所揭示的,就是“自然界中有效能量不断减少”这种不可逆性。
热力学第一定律的基本概念是能量,热力学第二定律的基本概念是熵。熵的概念虽然曾被视为“神秘的幽灵”,然而在回顾一百多年来人类的成败得失时,人们格外感到熵的概念的重要性和熵的理论的无限深邃;它已经在信息论、控制论、宇宙科学、生命科学乃至社会科学领域得到了广泛的应用。
有序向无序的转化
在热传递的过程中,两个物体的温度不同,或一个物体各部分之间的温度不同,这是一种比较“不均匀”的状态。当热传递过程结束时,两物体之间或一个物体的各部分之间的温度相同了,这是一种比较“均匀”的状态。在热传递过程中,系统可以自发地从比较不均匀的状态变为比较均匀的状态。
一个箱子被隔板分为左右两室,左边有气体,右边是真空。一旦隔板撤去,气体会从左向右膨胀。气体分子集中于一侧的状态,是比较“不均匀”的状态,而气体分子平均地分布在左右两室,这是比较“均匀”的状态。这也是个不可逆过程,过程的方向是从比较不均匀的状态变为比较均匀的状态。
比较不均匀的状态是比较有序的状态。例如图2.5-1中“分子集中于左室,右室没有分子”,这是一种秩序,而所有分子均匀分布在两室,属于没有秩序。这就好像学生做操,按一定规则站队,比较有序,而解散之后的杂乱分布,比较无序。
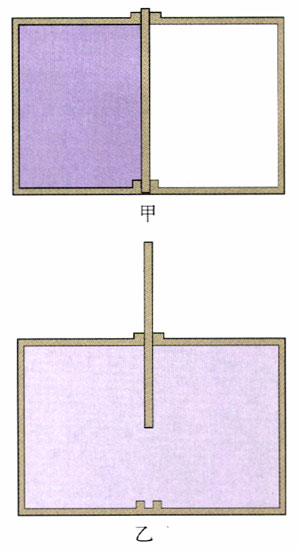
从微观的角度说,热传递过程也是从比较有序的状态变成比较无序的状态。例如,物体甲的温度比乙高,说明甲的分子的热运动比较剧烈,这是一种秩序。达到热平衡后两者的温度一样了,两个物体的分子的热运动没有区别了,变为无序。
生活中的例子也很多。一座高楼,砖、瓦、钢筋、玻璃的排列整齐有序;爆破后倒塌成一堆废墟就杂乱无序了。一树绿叶,排列有序;秋风一吹,叶落遍地,就乱糟糟无序可循了……
概括以上分析我们认识到,系统自发的过程总是从有序变为无序的。前面已经知道,系统总是从熵比较小的状态变为熵比较大的状态,由此可见,熵是表征系统的无序程度的物理量,熵越大,系统的无序程度越高。
科学漫步
生命和熵
把水洒在地上,水就会渗到泥土中;把颜料放到水里它就会均匀地扩散开,这都是符合热力学第二定律的。但是,生物界不少过程却与此相反。例如,生长在干旱田地里的西瓜,水分不仅不会从西瓜渗到泥土里,反而会从泥土里聚集到西瓜中。海带和紫菜也能把分散在海水里的碘集中起来,这就是生物的“富集现象”。初看起来,这些现象似乎与热力学第二定律不一致。此外,生命体本身就是一个高度有序的系统,它由那么多细胞组成多种组织,形成多种有特定职能的器官和多种生理系统,共同保证着生物的生命活动。而这些居然是从嚼碎的食物变化而来的!
生命系统也是自然界的一部分。如果自然界的自发过程总是从有序走向无序,那么怎么会从中产生高度有序的生命体呢?
1944年,奥地利物理学家薛定谔指出,生命活动必然服从已知的物理学定律,包括热力学的基本原理。他还指出,生命体在其内部时时刻刻都在“制造”着熵,即熵在增加着,这是符合熵增加原理的。的确,生命活动是一个耗散过程,从食物的发酵到人的劳作,都要生热。在能量的耗散过程中,熵要不断增加,即无序性和混乱性增加。对于生命来说.熵达到最大值就是死亡。所以,要活着,生物有机体就必须使自身保持低熵的状态,如何能做到这一点呢?
薛定谔回答说:“靠吃、喝、呼吸,专门的术语叫‘新陈代谢’。”他还进一步指出:“新陈代谢的本质,就是使有机体成功地消除它自身内部不断产生的熵。”这就是说,通过新陈代谢活动,降低生命有机体的熵,来抵消生命活动中产生的熵的增加,从而使自身维持在一个稳定的低熵状态。所以,薛定谔认为有机体是依赖熵的减少来生存的。这就是生命的热力学基础。

热力学第二定律告诉我们,一个与外界没有物质和能量交流的封闭系统,它的熵只能增加,不能减少。但是,生命有机体却是一个开放系统,它不断地吃、喝、呼吸.又不断地排泄,生命体与外界不断有物质和能量的交流,在这种交流中,它一面从外界摄入低熵的物质,一面向外界排出高熵的物质,使有机体维持在低熵状态。一旦生物有机体同他生存所必需的环境隔离开来,成为一个孤立系统,那么机体就会死亡、腐烂,走向无序。
问题和练习
1.地球上的最高气温和最低气温相差多少摄氏度?
2.根据你对熵增加原理的理解,举出一些系统从有序变为无序的例子。
3.自然过程的方向性是从有序状态自发地转向无序状态。如何根据这种理论说明热传递和做功生热两种过程的不可逆性?
[1] 在表示温度的差值时.K与℃的意义相同,因此分别以K和℃为单位的物理量可以相加减。
发布时间:2018/5/17 上午10:12:12 阅读次数:7037
