第八章 2 气体的等容变化和等压变化
一定质量的某种气体,在体积不变时,压强随温度的变化叫做等容变化;在压强不变时,体积随温度的变化叫做等压变化。
气体的等容变化
法国科学家查理(J.A.C.Charles,1746~1823)在分析了实验事实后发现,当气体的体积一定时,各种气体的压强与温度之间都有线性关系(图8.2-1甲),我们把它叫做查理定律(Charles law)。
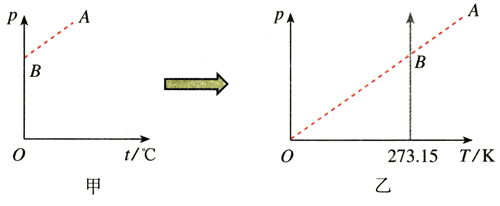
从图8.2-1甲可以看出,在等容过程中,压强p与摄氏温度t是一次函数关系,不是简单的正比例关系。但是,如果把图8.2-1甲中的直线AB延长至与横轴相交,把交点当做坐标原点,建立新的坐标系(图8.2-1乙),那么这时的压强与温度的关系就是正比例关系了。图乙坐标原点的意义为“气体压强为0时其温度为0”。可以证明,当气体的压强不太大、温度不太低时,坐标原点代表的温度就是热力学温度的零度。所以说,在p-T图象中,一定质量某种气体的等容线是一条通过坐标原点的直线。这时,查理定律可以表述为:一定质量的某种气体,在体积不变的情况下,压强p与热力学温度T成正比,即p∝T。写成等式的形式就是
p=CT或\(\frac{p}{T}\)=C
其中C是比例常数。
在我们的计算中,相当于大气压几倍的压强都可以算做“压强不太大”,零下几十摄氏度的温度也可以算做“温度不太低”。
这里的C和玻意耳定律表达式中的C都泛指比例常数,两者并不相等。
“压强p与热力学温度T成正比”也可以表示为另外的形式,即
\(\frac{{{p_1}}}{{{T_1}}}\)=\(\frac{{{p_2}}}{{{T_2}}}\)或\(\frac{{{p_1}}}{{{p_2}}}\)=\(\frac{{{T_1}}}{{{T_2}}}\)
气体的等压变化
也可以用实验研究一定质量的某种气体在压强不变的情况下其体积V与热力学温度T的关系。在V-T图象中,等压线是一条过原点的直线(图8.2-2)。
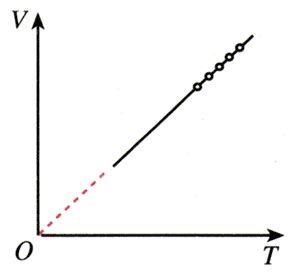
法国科学家盖-吕萨克(J.Gay-Lussac,1778~1850)首先通过实验发现了这一线性关系,我们把它叫做盖-吕萨克定律(Gay-Lussaclaw:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比,即
V=CT或\(\frac{V}{T}\)=C
其中C是比例常数。盖-吕萨克定律表示成另外的形式就是
\(\frac{{{V_1}}}{{{T_1}}}\)=\(\frac{{{V_2}}}{{{T_2}}}\)或\(\frac{{{V_1}}}{{{V_2}}}\)=\(\frac{{{T_1}}}{{{T_2}}}\)
这里的C和玻意耳定律、查理定律表达式中的C都泛指比例常数,它们并不相等。
【例题】如图8.2-3,某种气体在状态A时压强为2×105 Pa,体积为1 m3,温度为200 K。
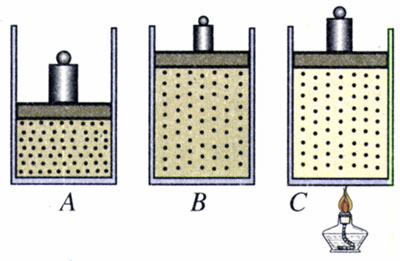
(1)它在等温过程中由状态A变为状态B,状态B的体积为2 m3。求状态B的压强。
(2)随后,又由状态B在等容过程中变为状态C,状态C的温度为300 K。求状态C的压强。
【解】(1)气体由状态A变为状态B的过程遵从玻意耳定律。
由
pAVA=pBVB
得状态B的压强
pB=\(\frac{{{p_{\rm{A}}}{V_{\rm{A}}}}}{{{V_{\rm{B}}}}}\)=\(\frac{{2 \times {{10}^5} \times 1}}{2}\)Pa=105 Pa
(2)气体由状态B变为状态C的过程遵从查理定律。
由
\(\frac{{{p_{\rm{B}}}}}{{{T_{\rm{B}}}}}\)=\(\frac{{{p_{\rm{C}}}}}{{{T_{\rm{C}}}}}\)
得状态C的压强
pC=\(\frac{{{p_{\rm{B}}}{T_{\rm{C}}}}}{{{T_{\rm{B}}}}}\)=\(\frac{{{{10}^5} \times 300}}{{200}}\)Pa=1.5×105 Pa
问题与练习
1.盛有氧气的钢瓶,在17℃的室内测得氧气的压强是9.31×106 Pa。当钢瓶搬到-13℃的工地上时,瓶内氧气的压强变为8.15×106 Pa。钢瓶是不是漏气?为什么?
2.如图8.2-4,向一个空的铝制饮料罐(即易拉罐)中插入一根透明吸管,接口用蜡密封,在吸管内引入一小段油柱(长度可以忽略)。如果不计大气压的变化,这就是一个简易“气温计”。已知铝罐的容积是360 cm3,均匀吸管内部的横截面积为0.2 cm2,吸管的有效长度为20 cm,当温度为25℃时,油柱离管口10 cm。
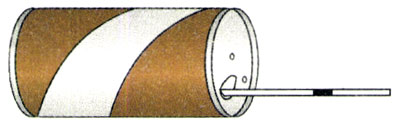
(1)吸管上标刻温度值时,刻度是否应该均匀?
(2)估算这个气温计的测量范围。
文件下载(已下载 198 次)发布时间:2017/5/18 下午3:48:23 阅读次数:3117
