第八章A 热力学第一定律教学建议
(一)学习目标
1.理解热力学第一定律。理解物质系统内能的变化是与外界(通过做功和传热的方式)交换能量的结果,热力学第一定律反映了这种能量交换和能量变化过程中的规律性。
2.关注热力学第一定律的建立过程,学习通过对自然界,以及生活、生产实际问题的分析、推理得出物理规律的研究方法。
3.通过热力学第一定律的学习,懂得能量概念以及能的转化和守恒定律的意义及其在科学史上的重要地位,感悟物理学对技术、社会的发展所起到的重要作用。
(二)重点和难点
本节重点是热力学第一定律,以及它对理想气体系统的应用。
本节难点是在应用热力学第一定律时,有关的三个物理量(内能的增量ΔU、功W、热量Q)正负号的确定,以及热力学第一定律对理想气体系统的应用。
(三)教学建议
本节教学中要充分利用基础型物理课程中学过的有关知识,包括内能、引起内能变化的两条途径,以及能的转化和守恒定律、理想气体定律等。但在用到这些知识时要安排一定的时间,引导学生进行回顾、复习。在本节第一小节“热力学第一定律”中,应注意从量和质两个方面来揭示该定律的意义,阐明该定律在科学史上的地位,第二小节“热力学第一定律对理想气体的应用”中,利用热力学第一定律可对理想气体的几种典型过程,如等温、等容、等压等过程中系统内能的变化,以及与外界的功和热量的交换有进一步的认识,这不仅能加深对热力学第一定律的理解,而且有助于体现过程与方法(见本节学习目标2)、情感态度与价值观(见本节学习目标3)的教学目标。
1.情景引入的编写意图
引起内能变化(ΔU)的两条途径,即做功(W)和传递热量(Q)的有关知识,学生在基础型物理课程中已有所了解,课本中图8-1所示的实验,以及课本第113页所设计的“大家谈”不过是为了引导学生回顾已有的知识而提供的一个实际例子。通过这个例子,使学生对热和功的转化过程(常称为热力学过程)有一个清晰的认识;对系统、外界、状态量(如内能、温度、压强等)、过程量(如功、热量等)有一个清晰的概念,不过,对于高中学生来说,没有必要对这些概念一一给出定义,也不要求学生理解、背诵,只需知道大概意思就行了。
2.关于课本第113页“大家谈”的参考答案
课本第133页“大家谈”的参考答案可在本小节的第一段文字中找到。在我们所考察的两个热力学过程中,研究对象分别是铜管(应将它看作由铜分子所构成的一个物质系统)和管内的乙醚。这简单实验表明,热和功之间的转化并不是直接进行的,其间必须经过某个系统(如铜管或乙醚)的内能的变化。
在图8-1的实验中,如果将铜管中的乙醚类比为热机汽缸中的油气混合物,橡皮塞类比为汽缸中的活塞,则该小实验中通过乙醚的热量转化为机械功的过程就可与热机汽缸的主要工作过程相类比。从物理原理上说,这种热量转化为功的过程是热机的最重要、最基本的工作过程,在此基础上,工程师采用了汽缸中活塞的往复运动,以便不断地重复这种能量转化过程,发明了曲轴连杆机构,以便将活塞的往复直线运动转化为汽车轮子的转动运动。
3.关于热力学第一定律的教学建议
根据以往教学经验,学生不难接受热力学第一定律所揭示的量的关系。在教学中要注重引导学生对该定律意义的理解。热力学第一定律实际上就是包括内能的能的转化和守恒定律。物理学的生命力在于它的不断发展。内能和热力学第一定律的学习使学生对能量的认识从力学拓展到热现象。跨出了这一步,今后就容易理解电磁能、核能等,就能领悟能量的多样性,体会能量概念及其所遵循的规律在人类认识和利用自然中的重要地位。
从历史的发展来看,19世纪40年代物理学家焦耳的工作使人们首先认识到内能中与分子热运动相关的那部分能量(后来长期称之为“热能”),建立了能的概念以及涉及机械能和热能转化过程的热力学第一定律。1864年,麦克斯韦在法拉第电磁感应定律和场的观念指引下,发现了电磁场,建立了“电磁能”的概念,其后人们又发现了“质能”(1905年,爱因斯坦)、“核能”等,从而形成了现代涵义下能的概念,以及能的转换和守恒定律。
4.关于“热力学第一定律对理想气体的应用”的教学建议
热力学第一定律对理想气体的应用主要是指,运用热力学第一定律及理想气体状态方程,定性考察一定质量的理想气体系统在某些典型过程中,其内能的改变(ΔU)以及系统与外界的功W和热量Q交换情况,了解哪些过程有功的交换,哪些过程有热的交换,哪些过程有功转变为热,哪些过程有热转变为功。这些分析和讨论有助于对热力学第一定律的理解,有助于了解热力学第一定律在各类热机设计和应用中的作用。
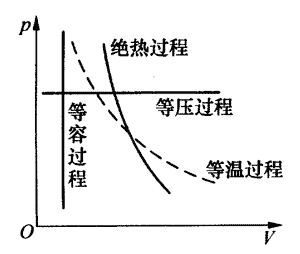
如图8-1所示,一定质量理想气体典型的热力学过程有:体积不变的“等容过程”、压强不变的“等压过程”、温度不变的“等温过程”,以及与外界没有热量交换的“绝热过程”等,下表列出了在这些过程中系统的状态参量:压强、体积、温度、内能的变化情况(用“+”表示增加,“-”表示减小),以及过程中与外界的功和热量的交换情况。此表仅供教师在解答或设计问题时参考,死记硬背则毫无用处。
| 热力学过程 | Δp | ΔV | ΔT | ΔU | W | Q |
|---|---|---|---|---|---|---|
| 等压膨胀 | 0 | + | + | + | - | + |
| 等压压缩 | 0 | - | - | - | + | - |
| 等容放热 | - | 0 | - | - | 0 | - |
| 等容吸热 | + | 0 | + | + | 0 | + |
| 等温膨胀 | - | + | 0 | 0 | - | + |
| 等温压缩 | + | - | 0 | 0 | + | - |
| 绝热膨胀 | - | + | - | - | - | 0 |
| 绝热压缩 | + | - | + | + | + | 0 |
5.课本第115页“自主活动”的参考答案
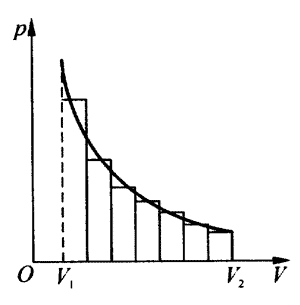
功的数值等于过程的p-V图线和V轴所围面积这个结论对于p不是恒定的过程依然成立,说明如下:如图8-2所示,将横轴上V1V2分成相等的n个小段,此时图中的等温过程可近似为由n个矩形条的上边构成的折线所表示的一个过程。折线的每一小段是等压过程,系统在这小段等压过程中与外界交换的功已经证明在数值上等于相应矩形条的面积。因此在折线描写的过程中系统与外界交换的功数值上等于行个矩形条的面积之和。当n趋于无穷大时,折线趋近于等温曲线;n个矩形条的面积之和趋近于等温曲线与V轴所围面积。
(四)作业说明
本章共13题,许多定性的习题,如第4、5、6、7,以及第11、12和13题都可安排在课堂中进行讨论。
参考答案
A组
1.内能增加;内能减小
2.放出了150J热量
3.增加了600J
4.(1)ΔU>0;(2)ΔU>0;(3)ΔU<0;(4)不确定
5.(1)可能,只要同时对外做等量的功(即-W=Q);(2)可能,只要同时向外放出等量的热(即-Q=W);(3)不可能,因为Q+W=ΔU=0,Q=0,则W=0;(4)不可能,因为Q+W=ΔU=0,Q<0,则W=-Q>0
6.(1)不一定正确,物态改变时,内能有变化,但温度不变。这种说法只对一定质量的理想气体系统成立;(2)正确???;(3)不一定正确,若同时对外做功,它的内能也可能不变或减小;(4)不一定正确,若同时从外界吸热,它的内能也可能不变或增加
7.(1)不正确,因W=0,Q=ΔU>0,所以要吸热;(2)正确,因W<0,Q=ΔU-W>0;(3)不正确,因Q=0,W=ΔU>0,所以要外界对气体做功,气体体积被压缩;(4)正确,因Q<0,W=ΔU-Q>0
8.过程a中输出的功为500J;过程c中为0;过程b中为-300J
B组
9.a;b和c;a;b和c;a;b和c
10.(1)W=-5.25×105J,即系统对外界做功;(2)Q=5.25×105J,即系绕从外界吸热
11.上升时气团膨胀,推挤周围的空气,对外做功,所以内能减小,温度降低
12.不相同。压强不变时,吸热后气体的体积要膨胀,故压强不变时吸收的热量QP中有一部分要转化为对外作的功,所以当温度升高相同时,Qp>Qv,其中Qv为体积不变时吸收的热量。因此,气体的比热容应当区分为“定压比热容”和“定容比热容”两类,且前者的值大于后者
13.(1)系统从外界所吸收的热量等于该系统的内能的增量与它对外界所做的功之和(2)按照本题中热力学第一定律的公式表示,Q、W、ΔU的正负号应作如下规定:Q>0吸热,Q<0放热;W>0系统对外界做功,W<0外界对系统做功;ΔU>0内能增加,ΔU<0内能减小
文件下载(已下载 803 次)发布时间:2012/2/24 下午2:43:28 阅读次数:5411
