选择性必修三 第四章 原子结构和波粒二象性 参考资料
1.物理学家
(1)康普顿
康普顿是美国物理学家。他于 1916 年获博士学位,后在明尼苏达大学任教。在此任教的两年多时间里,康普顿完成了两项很有意义的工作,一项是提出电子半径为 1.85×10−10 cm 的假设,用以解释他用实验所确定的 X 射线强度与散射角的关系;另一项是确定了磁性晶体的磁化效应,并科学地预言了铁磁性起源于电子的内禀磁矩,后为他的学生于 1930 年证实。
康普顿最重大的贡献是康普顿效应及解释。1919 ~ 1920 年,康普顿去英国在 J.J.汤姆孙和卢瑟福的指导下以访问学者的身份在卡文迪什实验室工作,他进行了 γ 射线的散射实验,发现用经典理论无法解释实验结果。回国后他用单色 X 射线和布喇格晶体光谱仪做实验,通过从不同角度在靶周围测量散射 X 射线波长,发现散射波中含有波长增大的波,该现象就是著名的康普顿效应。康普顿指出:散射应遵从能量守恒和动量守恒定律,出射 X 射线波长变长证明了 X 射线光子带有量子化动量。1922 年,他采用单个光子和自由电子的简单碰撞理论,对这个效应给出了满意的理论解释。
康普顿效应是近代物理学的一大发现,它进一步证实了爱因斯坦的光子理论,揭示出光的二象性,从而导致了近代量子物理学的诞生和发展;另一方面康普顿效应也阐明了电磁辐射与物质相互作用的基本规律。因此,无论从理论或实验上,它都具有极其深远的意义。康普顿因此获得 1927 年度诺贝尔物理学奖。中国物理学家吴有训在康普顿实验室做了大量实验,取得了令人信服的实验根据,排除了学术界对康普顿理论的异议,为康普顿的工作作出了宝贵的、不可多得的贡献。
(2)J.J.汤姆孙
J.J.汤姆孙是英国物理学家,电子的发现者。他最重要的贡献是发现了电子。最初,由于对麦克斯韦的电磁辐射理论感兴趣,他进行了阴极射线的研究。X 射线的发现使人们对气体电离行为的考察更加深入,在阴极射线本质的争论中他明确支持粒子说。接着他用一个巧妙的实验成功地证实了阴极射线在电场和磁场中发生偏转——这是判定阴极射线确实是带电粒子的决定性证据。继而,他采用静电偏转力和磁场偏转力相抵消等方法确定阴极射线粒子的速度,测量出这些粒子的比荷,并进一步测出它们的质量约为氢原子质量的 \(\dfrac{1}{{1837}}\)。由此推断,阴极射线粒子比原子要小得多,可见这种粒子是组成一切原子的基本材料。J.J.汤姆孙于 1897 年 4 月 30 日宣布了他的发现。后来人们命名这种粒子为电子,电子是人类所认识的第一种基本粒子。此后,他又提出了“电子浸浮于均匀正电球”的原子结构模型(“枣糕”模型)。该模型虽然在后来被卢瑟福的核原子模型所替代,但它是建立原子结构模型的开端。1906 年,由于 J.J.汤姆孙对电子研究的重要贡献而被授予诺贝尔物理学奖,1908 年又被册封为爵士。
J.J.汤姆孙的另一个重要贡献是在研究极隧射线(穿过阳极细孔的带正电的粒子流)时发展了质谱方法。他的方法经过同事阿斯顿的改进和完善,发展为今天的质谱仪。在极隧射线的研究中,他根据实验现象最先指出,普通元素也可能有同位素。1913 年首次用物理方法成功地分离出了稳定元素的同位素,从而确立了这一事实。他也是经典金属电子论的创始人之一。
此外,J.J.汤姆孙还是一位卓越的教师和科研事业领导人。他曾在卡文迪什实验室担任教授职位长达 34 年。这期间,他创建了完整的研究生培养制度并培育了良好的学术风气。他理论与实验并重,特别提倡自制仪器,又善于抓住要害,进行精确的理论分析。他的博学、敏捷、科学直觉、想象力与创造力带领着一大批学者前进在科学前沿上,使卡文迪什实验室成为国际物理前沿研究中心之一。他的学生有 7 人获诺贝尔奖,27 人取得英国皇家学会会员资格。他还努力促进大学与中学物理教学的提高,写出了几本出色的教材。英国能够在 20 世纪前 30 年在原子物理学领域保持重要的领先地位,J.J.汤姆孙的有力指导和优秀教学能力起了相当大的作用。
(3)卢瑟福
卢瑟福是英籍新西兰物理学家。他对科学的重要贡献主要有三方面。第一方面是关于放射性的研究。继 1898 年贝克勒尔发现放射性现象后不久,卢瑟福发现了铀放射性辐射的不同成分——α 射线和 β 射线。1900 年提出了重元素自发衰变理论。1904 年总结出放射性产物链式衰变理论,奠定了重元素放射系元素移位的基本原理。他的发现打破了元素不会改变的传统观念,使人们对物质结构的研究进入了原子内部的深层次,为开辟一个新的学科领域——原子核物理做了开创性工作。他由于“在元素蜕变及其放射化学方面的研究”而荣获 1908 年度诺贝尔化学奖。第二方面是 1911 年提出了原子的有核结构模型。1908 年卢瑟福用实验证明了 α 粒子就是氦离子。此后,他通过 α 粒子被物质散射的研究,从理论和实验验证上无可辩驳地论证了原子的有核结构模型,从而把原子结构的研究引向正确的轨道。因此,他被誉为“原子物理学之父”。1919 年人工核反应的实现是卢瑟福的第三项重大发现。这一发现过程可以作为卢瑟福科学方法与作风的典型例证之一。1915 年,他的学生马斯登发现用 α 粒子轰击空气时出现一些粒子,它们具有不寻常的长射程。卢瑟福决心利用业余时间长期而耐心地搞清楚这些粒子到底是 N、He,还是 H 原子、Li 原子?他设计了装置,为了使他的结果绝对可靠,他花了 3 年时间于 1919 年证明,这是 α 粒子轰击 N 核后使之衰变放出了氢原子核即质子:147N + 42He → 178O + 11H。这一装置的成本极为低廉,但用显微镜观察屏上闪烁的工作极为艰苦!这一实验的成功引起了一场热烈争论,最后以云室照片证明了卢瑟福的正确而告终。这标志着人类第一次实现了改变化学元素的人工核反应。古代炼金术士转化元素的梦想终于变成了现实!
此外,他还预言了重氢和中子的存在,这在后来都得到了证实。他同查德威克和艾利斯合作,于 1930 年出版了巨著《从放射性物质发出的辐射》,这部著作是早期核物理学的总结并具有当代水平。
(4)玻尔
玻尔是丹麦物理学家。他于 1912 年 3 月开始跟随卢瑟福工作。他从研究不同的铝片对 α 射线的吸收问题开始,思考原子结构问题,并超负荷地全力工作。当时人们对原子内部结构知之极少,只停留在光谱学和化学元素周期表的经验水平上。同时,按照卢瑟福的有核模型,明显地出现了正常状态下原子和分子的稳定性问题。不突破经典理论的框架,这一矛盾是难以解决的。1912 年 7 月,他尝试着把量子概念和有核模型结合起来,写了一份论文提纲给卢瑟福。这一提纲后来被史学界称为《卢瑟福备忘录》。1912 年 9 月,他受聘在哥本哈根大学任教。他利用业余时间奋发努力,形成了自己的理论。1913 年 7 月起,他以《论原子构造和分子构造》为题,连续三次在英国《哲学杂志》上发表论文,后来被称为“伟大的三部曲”。这篇论文的三大部分是:“正核对电子的束缚”“只包含单独一个原子核的体系”“包含多个原子核的体系”。论文提出了五条公设(后来一般教科书中归纳为三条)。在玻尔的原子理论中,最重要的是引入了“定态”和“跃迁”这两个全新的概念。“定态”概念把经典物理学在一定边界条件和初始条件下所允许的各种连续状态进行筛选,只允许某些分立状态存在,从而排除了定态之间的其他状态,形成若干鸿沟。“跃迁”(最初叫“过渡”)则把一个定态到另一定态的变化看成一种突然的、整体的、不需时间的行为,不允许经典物理那种逐渐的、连续的、分阶段动作。两个状态之间的能量差形成了原子发射和吸收光的机制。这两个新概念解释了原子世界中原来互不关联的许多实验事实,如 α 粒子大角度散射,氢原子线光谱的各种公式,不同元素的 X 射线谱等。玻尔理论促进了新谱线系(如赖曼系)的寻求和概括,核算了里德伯常量。天文学上发现的星体上的某些谱线(皮克林系)原来人们认为是属于氢原子,玻尔理论指出应属于氦原子并得到了实验验证。弗兰克和赫兹通过碰撞测出原子的“电离能”,玻尔指出这是原子的“激发能”,由此可以肯定地证明原子定态的存在。玻尔的成功使他 1916 年(31 岁)担任了哥本哈根大学教授,1917 年被选为丹麦科学院院士。
为了克服说明其他元素光谱时遇到的困难,并且进一步解释光谱线的强度、偏振以及原子其他诸多性质,说明元素周期表的构成等,1918 年玻尔提出了对应原理,它的大意是说:在同一问题的经典理论与量子理论之间,总可以从形式上找到相对应的类比关系。他认为:对一个周期性体系来说,用经典理论(如用经典广义坐标中的傅立叶系数)来描述周期性体系的运动,和用量子理论(如体系的跃迁概率)来描述时,两者存在着简单的对应关系。这一理论后来导致了海森堡矩阵力学的发展。玻尔利用这一原理,合理地解释了众多的现象,如各元素的光谱与 X 射线谱、原子中电子的组态和元素周期表等。1922 年 12 月,玻尔由于上述这些成就荣获诺贝尔物理学奖。
1921 年,玻尔倡议并建立了哥本哈根大学理论物理学研究所,并领导这一世界性的科学中心 40 年,形成著名的哥本哈根学派,在量子力学的发展中起着独特的作用,取得了许多重大的成果,并培养出大批优秀的学者。例如,玻尔的对应原理导致了海森堡矩阵力学的形成;在相互的启发鼓励下涌现了玻恩对波函数的概率诠释;海森堡的不确定性原理;以及后来玻尔提出的互补原理等。20 世纪 30 年代中期,玻尔还提出了关于原子核构成的“液滴模型”、复合核概念等,促进了重核裂变的发现和原子核能的研究。
(5)德布罗意
德布罗意是法国物理学家。他在大学里接受的是文科教育,1910 年获巴黎大学文学学士学位。1911 年,他听到作为第一届索尔维物理讨论会秘书的莫里斯谈到关于光、辐射、量子性质等问题的讨论后,激起了强烈兴趣,特别是他读了庞加莱的《科学的价值》等书,他转向研究理论物理学。1913 年,他获理学硕士学位。第一次世界大战期间,在埃菲尔铁塔上的军用无线电报站服役。他的哥哥是 X 射线方面的专家,战后他一方面参与他哥哥的物理实验工作,一方面拜朗之万为师,研究与量子有关的理论物理问题,攻读博士学位。
光的波动和粒子二象性被发现后,许多著名的物理学家感到困扰。年轻的德布罗意却由此得到启发,大胆地把波粒推广到物质客体上去。他在 1923 年 9 ~ 10 月,连续在《法国科学院通报》上发表三篇短文:《辐射——波和量子》《光学——光量子、衍射和干涉》《物理学——量子、气体动理论及费马原理》。在 1924 年通过的博士论文《量子论研究》中他作了系统阐述,提出了德布罗意波(相波)理论。这一理论以后被薛定谔接受从而促进了波动力学的建立,并且把爱因斯坦关于光的波粒二象性的思想加以扩展。他认为实物粒子如电子也具有物质周期过程的频率,伴随物体的运动也有由相位来定义的相波即德布罗意波,后来薛定谔解释波函数的物理意义时称为“物质波”。
德布罗意的新理论在物理学界掀起了轩然大波。这种在并无实验证据的条件下提出的新理论使得人们很难接受。就连德布罗意的导师朗之万也根本不相信这种观念,只不过觉得这篇论文写得很有才华,才让他得到博士学位。
1927 年,美国贝尔实验室的戴维森、革末及英国的 G.P.汤姆孙通过电子衍射实验,都证实了电子确实具有波动性。至此,德布罗意的理论作为大胆假设而成功的例子获得了普遍的赞赏,他荣获了 1929 年诺贝尔物理学奖。
2.光电管
光电管是应用光电效应原理制成的光电转换器件。在抽出空气的玻璃壳内,半面涂上光电发射材料做阴极,并封入球状或环状的金属阳极,就制成了真空光电管。可见光光电管可用普通玻璃制作;紫外线光电管必须用石英玻璃制作。若在管内充入少量惰性气体,就成为充气光电管。光电材料是多种多样的,可用锂、钠、钾、铷、铯、银,以及锑与钾、钠、铯等制成的复合材料。应根据使用的光谱波段,选用量子效率(释放的电子数与入射的光子数之比)高和暗电流(完全没有光照时的板极电流)小的光电材料。
充气光电管,工作中会产生气体放电电流,使光电管的灵敏度增大几倍乃至十几倍。但如果电压过高,会产生辉光放电,无法用光照控制电流,阴极材料也会损坏。因此,在电路里要串接高阻值的保护电阻。真空光电管具有稳定性好、响应迅速、寿命长、光照和输出电流间有良好线性关系等优点。
光电管在光度测量、有声电影、电送传真、自动计数、自动控制、自动报警等方面有广泛应用。但由于它灵敏度低、体积大、易破碎,正逐步被固体光电探测器所取代。
3.康普顿效应的理论计算
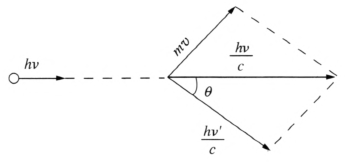
图 4–3 表示入射光子的动量 \(\dfrac{{h\nu }}{c}\)、散射光子的动量 \(\dfrac{{h\nu '}}{c}\) 和碰撞后的电子的动量 mv 三个矢量之间的关系。由动量守恒定律得
\[{(mv)^2} = {\left( {\frac{{h\nu }}{c}} \right)^2} + {\left( {\frac{{h\nu '}}{c}} \right)^2} - \frac{{2{h^2}}}{{{c^2}}}\nu \nu '\cos \theta \tag*{①}\]
考虑到电子在散射后可能有很大的反冲速度,所以在列出能量守恒方程式时应当注意电子质量与速度的关系。电子原来是静止的,能量为 m0c2;碰撞后,能量为 mc2。光子的能量原来为 hν,碰撞后为 hνʹ,所以能量守恒的条件为 hν + m0c2 = hνʹ + mc2,即 mc2 = h(ν − νʹ)+ m0c2。取其二次方,得
\[{m^2}{c^4} = {h^2}{\nu ^2} + {h^2}{{\nu '}^2} - 2{h^2}\nu \nu ' + m_0^2{c^4} + 2h{m_0}{c^2}(\nu - \nu ')\tag*{②}\]
将第①式各项乘以 c2,得
\[{m^2}{v^2}{c^2} = {h^2}{\nu ^2} + {h^2}{{\nu '}^2} - 2{h^2}\nu \nu '\cos \theta \tag*{③}\]
把②③两式相减,得
\[{m^2}{c^2}({c^2} - {v^2}) = m_0^2{c^4} - 2{h^2}\nu \nu '(1 - \cos \theta ) + 2h{m_0}{c^2}(\nu - \nu ')\]
按狭义相对论质量关系式,m02c4 = m2c2(c2 – v2)即得
\[h\nu \nu '(1 - \cos \theta ) = {m_0}{c^2}(\nu - \nu ')\tag*{④}\]
利用关系式 ν = \(\dfrac{c}{\lambda }\),νʹ = \(\dfrac{c}{{\lambda '}}\),④式可写为
\[\frac{{h{c^2}}}{{\lambda \lambda '}}(1 - \cos \theta ) = {m_0}{c^2}\frac{{c(\lambda ' - \lambda )}}{{\lambda \lambda '}}\]
最后得
\[\Delta \lambda = \lambda ' - \lambda = \frac{h}{{{m_0}c}}(1 - \cos \theta ) = \frac{{2h}}{{{m_0}c}}{\sin ^2}\frac{\theta }{2}\]
h、c 和 m0 都是已知的,则可算出 \(\dfrac{h}{{{m_0}c}}\) = 0.002 41 nm。这和观察结果符合。
这种理论计算和实验结果的符合,说明了能量守恒和动量守恒两个定律在微观现象中也严格地适用。大量的其他实验也都证实了这个结论。
4.原子结构的探索
原子是物质结构的一个层次。原子一词来自希腊语,意思是最小的、不可分割的物质粒子。自古以来,面对五彩缤纷、变化万千的自然界,人们一直在思索着这样一些问题:我们周围的物质世界到底是由什么构成的?有没有最小的物质单元结构?人们向往揭开物质结构之谜。世界上每一个古老民族都对物质本源的探索注入了自己对客观世界的理解。
在古代,人们主要靠直觉和猜想来描述世界。古埃及人和古巴比伦人认为世界万物是由水、气、土产生的。我们的祖先早在周代就提出了“五行”说,认为万物是由金、木、水、火、土这五种物质组成的。古希腊学者则认为土、气、水、火这四种元素是万物组成的本源。这些观点反映了低水平的生产条件下人们对日常生活经验的分析和概括。春秋战国时期,墨翟提出了“端”是物质的起始,是组成实体物质的一种极小的、最原始的微粒。他认为物质可以对半地分下去,如果剖分到“无”,就不能再剖分下去了,这里体现了原子说的思想。把构成物质的最小单元叫作“原子”的是古希腊唯物主义哲学家德谟克利特,其含义是不可再分割的意思。当时认为原子的种类和数量都无限多,在空间处于永恒的运动之中。这种观点对于 19 世纪末 20 世纪初才正式确立的近代“原子论”有直接和深刻的影响。
人们对于物质结构的探索经历了一个漫长的历史时期。从古希腊创立原子论以来,在 2 000 多年里没有多大的进展,一直到了 18 世纪后半期至 19 世纪中期,人们通过生产实践和大量化学、物理实验,才加深了对原子的认识。虽然严格把原子模型应用到气体分子动理论,最早是 18 世纪末由伯努利提出来的,但是,原子概念却首先在化学这个科学分支上表现出其重要性。19 世纪初,道尔顿的原子假设在定性地和定量地解释许多化学现象方面获得巨大成功。自 300 年前英国科学家玻意耳提出化学元素的概念并指出化学元素是不可再被分解的最简单的物质(当然,这是指只用化学的方法来分解物质)以来,到 19 世纪中期,随着科学技术的迅速发展,人们已经发现了 60 多种物质元素。这时,一个问题很自然地被提了出来:自然界究竟有多少种元素?它们之间有没有内在的联系?这些元素是不是由更简单的东西所组成?1869 年,俄国科学家门捷列夫从已发现的元素中发现了规律性,并将它们排列成“元素周期表”,从而揭示出一个非常重要而有趣的规律:元素的性质随着原子量的增加而呈现周期性的变化。根据表中的空缺,还预测了未发现的元素与特性。元素周期表是人类总结了对物质世界的认识的实践经验而产生的,它与阿伏加德罗定律和法拉第电解定律的发现一样,都是 19 世纪人们在探索物质结构的微观层次中所获得的重大成就。它们使原子假设成为高度可信的学说,但是真正确立原子的概念是在 20 世纪初。现在我们都知道我们周围的一切物质都是由元素构成的,每一种元素都有化学性质相同的原子。所以人们常说原子是构成物质世界的“基本砖石”。从现代物理学发展来看,人们对物质结构层次的认识也已经越来越深入,物质的最小构成单元已经不再是分子、原子,卢瑟福的 α 粒子散射实验揭示了原子的核式结构。后来人们又发现原子核是由质子和中子构成,20 世纪中、后期又发现了夸克和轻子……人类对物质微观结构的探索还在继续进行着。
5.光谱
光谱是复色光分解后按照波长顺序排列成的光带。广义的光谱,不限于可见光,包括一切波长的电磁辐射。光谱可分为发射光谱、吸收光谱和散射光谱三类。
发射光谱是光源发出的光直接经分光仪器分解后形成的,按光谱特征可分为线状谱、带状谱和连续谱三种。线状谱是游离的原子发光产生的,也叫原子光谱,其中只有一些分立的亮线,亮线之间是黑暗的区域。每种原子都有自己的独特的线状谱,根据光谱线的位置可以测出光的波长。氢原子光谱是最简单的原子光谱。氢原子光谱中最强的一条谱线是 1853 年由瑞典物理学家埃斯特朗探测出来的。由于他在光谱研究方面的贡献,后来曾以他的姓氏命名光波波长的单位,1 埃(Å)等于 10−10 m。采用国际单位制后,才不使用埃这个长度单位了。带状谱主要是由分子发光产生的,也叫分子光谱,其中有一些亮带。实际上,每一个亮带都不是连续的,而是由许多相隔很近的亮线组成的。连续谱是由炽热的固体、液体或高压气体发光产生的,其中包括一切波长的光,各种色光的分布是连续的,中间没有暗线或暗区。
吸收光谱是一束具有连续波长的光通过物质时,某些波长的光被吸收后产生的光谱。这种光谱是以连续光谱为背景,其中有暗线、暗带或暗区。不同物质产生的吸收光谱不同。
让炽热固体发出的白光通过较冷的钠蒸气(在酒精灯芯上放一些食盐,食盐受热分解就产生钠蒸气),可以看到在连续谱的背景上出现两条挨得很近的暗线,这两条暗线的波长恰好跟钠蒸气的发射光谱中两条黄色亮线的波长相同。实验表明,白光通过每一种气体时,光谱中都会产生一组暗线,每条暗线的波长都跟那种气体原子的一条特征谱线相对应。这表明每种气体都从通过它的白光中吸收跟它的特征谱线波长相同的那些光,使白光的连续谱中出现暗线。吸收光谱中的暗线也是原子的特征谱线,只是通常在吸收光谱中看到的特征谱线比明线光谱中的要少一些。
散射光谱是由散射光产生的光谱。在散射光中,除了与入射光频率相同的部分,还有一些新频率的光,这种散射叫作喇曼散射,这种散射光的光谱叫作喇曼光谱。
人类研究光谱已有一百多年的历史了。1666 年牛顿用棱镜得到太阳光谱,是对光谱最早的研究。太阳光谱是吸收光谱,但牛顿没有发现其中的暗线,因为他是使太阳光通过圆孔而不是通过狭缝产生的光谱。1802 年英国科学家沃拉斯顿和 1814 年夫琅禾费分别独立地观察到了太阳光谱中的暗线,夫琅禾费并认识到这些暗线有固定的位置,以不同的字母命名了一些主要的暗线。后来就把这些暗线叫作夫琅禾费线。1859 ~ 1861 年,基尔霍夫和本生解释了这些暗线,认为这些暗线是太阳光球发出的连续波长的光被太阳大气(主要是色球层)中的原子吸收产生的,并创立了光谱分析方法,即根据蒸气混合物所辐射的光谱来判断它的化学成分。1860 年本生用这种方法从含有锂、钠、钾的天然矿物中发现了两种新元素——铷和铯,后来又用光谱分析方法发现了铊(1862 年)、铟(1863 年)、镓(1875 年)和氦(1895 年)。氦是先从太阳大气的光谱中发现的,氦(helium)的命名就来源于希腊语的太阳(helios)。
光谱在科学研究中有重要作用。由于原子发光的频率与原子的结构和能级有关,因此研究发射光谱可以得到原子与分子的结构和能级的知识。吸收光谱主要用于研究分子的性质,特别是在有机化学分析中有重要应用,因为一定的原子团吸收一定频率的光。喇曼光谱与分子的振动和转动能级有关,因此研究喇曼光谱可以得到分子结构及其振动能级和转动能级的知识。喇曼光谱本来是很微弱的,有了激光器以后,很容易得到比较明显的喇曼光谱,使它的应用范围有了很大的扩展,并可用来分析空气质量、探测环境污染等。
6.测定氢光谱波长
【实验准备】
初步了解分光镜等实验仪器的构造。主要用到的仪器和器材有:分光镜(J2551-1 型),光谱管组(J2552 型),感应圈(J1206 型),低压电源(J1201 型或J1201-1 型,J1201-2 型),学生电源(J1202 型或J1202-1 型),照明灯(6 V)等。
J2551-1 型分光镜的光路如图 4–4 所示。光源发出的光经平行光管成为平行光,投射到三棱镜上。通过三棱镜的折射进入望远镜中,在望远镜的焦平面上聚焦成狭缝的像,通过目镜可观察到此像。如果光源是单色光,只有一个狭缝像。如果光源由几种波长组成,因三棱镜对不同波长的光的折射率不同,从三棱镜出射时,不同波长的光偏折的角度不一样,通过目镜可看到几个按一定规律排列的不同颜色的狭缝像。通常把狭缝像称为光谱线。
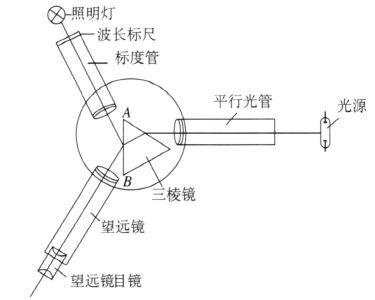
标度管中的波长标尺被照亮后,光线通过标度管物镜成平行光出射,经三棱镜 AB 面的反射也进入望远镜中,并在望远镜物镜焦平面上聚焦成像。这样,在望远镜中能同时看到光谱线(狭缝像)及波长标尺,谱线的波长可根据波长标尺刻度直接读出。
分光镜的外形如图 4–5 所示,它由平行光管、望远镜、标度管、三棱镜、托盘、支架等主要部件组成。
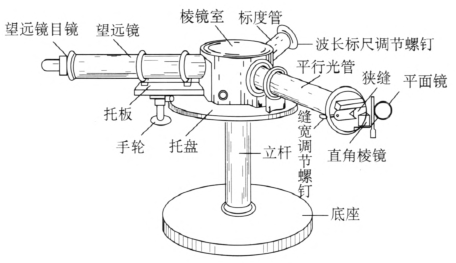
平行光管由物镜及狭缝组成。狭缝的缝长用燕尾形光栏调节,缝宽用微调螺钉调节。狭缝前有一块活动的平面镜及直角棱镜,用来采集比较光束,照明狭缝的下半部。
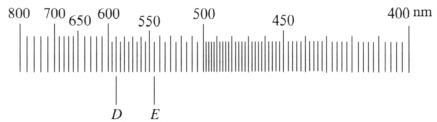
标度管由物镜及波长标尺组成。波长标尺是非等分刻度尺,在波长为 589.3 nm 的位置上标出 D 线(若使用精密的分光仪,可观察到钠双线,波长分别为 589.0 nm 和 589.6 nm),在波长为 546.1 nm 的位置上标出 E 线,如图 4–6 所示。
标度管前端两侧各有一只微调螺钉,用来调整波长标尺的位置。
望远镜由物镜和目镜组成,目镜有两只,可互换使用。高倍目镜放大倍数大,视场小;低倍目镜放大倍数小,视场大。
三棱镜安装在棱镜室中的棱镜台上。棱镜台、平行光管、标度管都固定在托盘上。望远镜固定在托板上,旋转手轮时通过齿轮齿条传动装置,带动望远镜筒绕固定轴转动,使所需观察或测量的谱线位于视场中心。
【实验 1】用分光镜观察氢光谱
(1)调节仪器
仪器受震动后,波长标尺的位置可能会移动,使用前需调整,方法如下。
用照明灯(如 J2507 型光具座中的光源)照明波长标尺,前后调节望远镜目镜,见到清晰的标尺刻线。在平行光管的狭缝前置钠光灯或汞灯。调节狭缝宽度,在望远镜中观察钠的 589.3 nm谱线(新的直读式分光镜可以看到钠的谱线有两条:589.0 nm、589.6 nm。当它们分不开时成为 1 条波长为 589.3 nm 的谱线)或汞的 546.1 nm 谱线,是否与波长标尺上的 D 刻线或 E 刻线重合。若不重合,调节标度管上的两只波长标尺微调螺钉。
进行上述调整时,钠、汞光源任选一种即可。如无钠光灯或汞灯、汞光谱管,可在酒精灯灯芯上加氯化钠(食盐),用酒精灯火焰代替钠光灯,或用日光灯代替汞灯。酒精灯火焰应距狭缝 100 mm 以上,以防食盐蒸气溅射到狭缝上。
(2)观察氢光谱
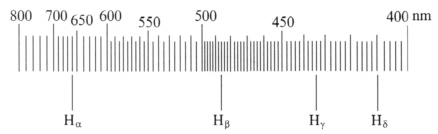
用感应圈激发氢光谱管,用它来照明狭缝,在望远镜中可观察到三条或四条明线光谱,如图 4–7 所示(一般情况下,Hδ 谱线观察不到)。
【实验2】用分光镜测定光的波长
(1)调节仪器
方法同上。
(2)熟悉波长标尺的刻度
用照明灯(如 J2507 型光具座的光源)照明分光镜的标尺。望远镜装上低倍目镜,前后调节目镜,在望远镜中观察到清晰的波长标尺像。旋转手轮,移动望远镜,使整个标尺都在望远镜的视场中。
波长标尺是非等分刻度尺,标度范围是 400 ~ 800 nm,在不同的波长区域,标尺的最小分度值是不同的。400 ~ 500 nm 为 2 nm/格;500 ~ 600 nm 为 5 nm/格;600 ~ 700 nm 为 10 nm/格;700 ~ 800 nm 为 20 nm/格。
(3)测定光的波长
旋转手轮,使波长标尺的 500 nm 刻线位于望远镜视场中央。移动狭缝前面的燕尾形光栏,使狭缝的长度为最大值。慢慢地按逆时针方向转动狭缝宽度的微调螺钉,把狭缝打开。用感应圈激发氢光谱管,并置分光镜狭缝前,在望远镜中就可以观察到氢光谱。如果光谱线比较宽,慢慢地按顺时针方向转动微调螺钉,减小狭缝的宽度。调节狭缝宽度时,边观察望远镜中的谱线边调节,避免狭缝闭合过紧,挤伤狭缝刀口。
转动手轮,把待测光谱线逐一移到望远镜视场的中央。根据波长标尺逐一读出氢光谱中红、蓝、紫色谱线对应的光的波长。
(4)根据光的波长计算里德伯常量及普朗克常量
根据巴耳末公式,氢光谱巴耳末线系各谱线的波长为
\[\frac{1}{\lambda } = {R_\infty }\left( {\frac{1}{{{2^2}}} - \frac{1}{{{n^2}}}} \right)\tag*{①}\]
R∞ 为里德伯常量,n = 3,4,5,…称为量子数。测出量子数 n 的谱线对应的光的波长 λ,即可计算出里德伯常量 R∞,即
\[{R_\infty } = \frac{{\frac{1}{\lambda }}}{{\left( {\frac{1}{{{2^2}}} - \frac{1}{{{n^2}}}} \right)}}\tag*{②}\]
计算时,波长以米为单位,1 nm = 10−9 m。里德伯常量的公认值为 1.097×107 m−1。
根据玻尔理论,氢原子从较高的能级(量子数 n = 3,4,5,…)跃迁到量子数 n = 2 的能级时,辐射出的光子属巴耳末线系,其能量差
\[h\nu = 13.6 \times \left( {\frac{1}{{{2^2}}} - \frac{1}{{{n^2}}}} \right)\]
或
\[h\frac{c}{\lambda } = 13.6 \times \left( {\frac{1}{{{2^2}}} - \frac{1}{{{n^2}}}} \right)\tag*{③}\]
式中 h 为普朗克常量。ν 为辐射出的光子频率,ν = \(\dfrac{c}{\lambda }\),c 为光速。13.6 是处于基态上的氢原子的电离能量,单位是电子伏特。测出巴耳末线系的谱线波长 λ,代入③式,即可计算出普朗克常量。计算时,波长以米为单位,电子伏特转化为焦耳(J),1 eV = 1.60×10−19 J。普朗克常量的公认值为 6.63×10−34 J·s。
下表列出了四条明线光谱的名称、对应的量子数、谱线颜色、波长理论值和测量值,以及根据②式计算得到的里德伯常量 R∞ 和根据③式计算得到的普朗克常量 h。
| 谱线名称 | Hα | Hβ | Hγ | Hδ | |
| 量子数 n | 3 | 4 | 5 | 6 | |
| 谱线颜色 | 红 | 蓝 | 紫 | 紫 | |
| 谱线波长/nm | 理论值 | 656.2 | 486.1 | 434.0 | 410.1 |
| 测量值 | 658.0 | 487.5 | 433.5 | 411.0 | |
| 里德伯常量 R∞ /(107 m−1) | 1.09 | 1.09 | 1.10 | 1.09 | |
| 普朗克常量 h/(10−34 J·s) | 6.64 | 6.64 | 6.61 | 6.63 | |
【注意事项】
(1)J2551-1 型分光镜是比较精密的光学仪器,应避免震动。平行光管、标度管及棱镜在出厂时均已调整好并固定,不要随便拆卸。
(2)调节狭缝宽度时,需边观察望远镜中的谱线边调节,避免狭缝闭合过紧挤伤刀口。
(3)如谱带上出现横向暗条纹,表明刀口上有灰尘,需要清洗。清洗时先把狭缝调宽,滴几滴无水酒精冲洗;或者用 6 ~ 8 mm 宽的纸片,对折后塞在狭缝里上下轻轻拉动,靠纸片的弹性把刀口上灰尘抹掉。
(4)感应圈的输出端电压很高,实验时应注意。
7.电子的波粒二象性
玻尔理论第一次从理论上解释了氢原子光谱的实验规律,揭示了微观领域里物质运动的一个基本特征——物理量的量子化。但是玻尔理论本身是矛盾的。它既承认经典理论的规律,又加上同经典理论基本概念相矛盾的量子化条件,成了经典与量子的混杂理论。一方面玻尔把电子看作经典力学中的粒子,在库仑力作用下绕核做圆周运动,另一方面又硬性规定没有电磁辐射产生,这显然是相互矛盾的。另外,当电子从高激发态跃迁到低激发态或基态时,只给出了所发射的电磁波能量与能级差的关系,没有说明电子是否可从高能态跃迁到任一低能态以及跃迁的概率是否一样等问题。事实上电子从高能态到低能态的跃迁是受一定限制的,有些能态间的跃迁不可能发生。在玻尔理论中找不到解决这些问题的答案。面对这些困难,人们期待着新思想的产生。
这个新思想就是电子的波动性,即电子与光子一样,具有波粒二象性。最早提出必须赋予电子以波动性的是德布罗意。1924 年,德布罗意在光的波粒二象性的启发下,提出了静止质量不为 0 的实物粒子也具有波粒二象性的假说。德布罗意当时还仅仅是巴黎大学的研究生,在爱因斯坦的光量子理论通过密立根、康普顿等研究得到证实后,德布罗意对此发生了兴趣,他认为在研究光的理论中,必须“同时引进粒子概念和周期性概念”。对于光本身必须同时考虑粒子性和波动性。他进一步研究了几何光学和经典力学的对应性,由此大胆设想,不仅光有粒子和波动两种性质,“一般的”物质也具有这两种性质。德布罗意认为:既然粒子概念成功地解释了令人困惑的康普顿效应,那么,波动概念也应能解释令人困惑的定态。
1923 年 9 月 10 日,德布罗意发表了题为《波和粒子》的论文,提出了物质波的概念。他认为像电子、质子、原子等粒子当被接收器接收到时,其质量、电荷、动量、能量等都显示出一份一份的颗粒性质,但从这些粒子的空间存在和运动特征上看,它们又有点像波。一定运动状态下的粒子同一定函数形式的波相似,当遇到适当的障碍物时会显示出衍射、干涉等波动性质。仿照爱因斯坦关系,德布罗意将粒子能量 ε、动量 p 与相应的物质波的波长 λ 与频率 ν 建立如下联系:ε = hν,p = \(\dfrac{h}{\lambda }\),称为德布罗意关系。对于动量为 p、能量为 ε 的自由运动粒子,描述其空间运动的物质波是单色平面波 \({\varphi _p}({\boldsymbol{r}},t) = A\exp \left[ {\dfrac{{i(\boldsymbol{p} \cdot \boldsymbol{r} - \varepsilon t)}}{h}} \right]\)。
由德布罗意关系,可求出几种物质粒子的物质波波长。
电子: 动能 Ek = 1 eV, 10 eV, 100 eV
波长 λ = 12.2 Å, 3.9 Å , 1.22 Å
微尘: 质量 m = 10−15 kg,速度 v = 1 cm/s
波长 λ = 6.6×10−7 Å
子弹: 质量 m = 20×10−3 kg,速度 v = 500 m/s
波长 λ = 6.6×10−25 Å
从上面的计算可知,微尘与子弹等粒子的物质波波长太短,以致无法察觉它们的波动性。因此,一般来说它们服从牛顿运动定律,只把它们看成粒子。但在微观领域,物质波的波长与它们运动的空间范围的线度同数量级,甚至还大。因此,如果还把电子看成是满足宏观运动规律的粒子来讨论其在微观领域中的运动,显然与事实不符,这也正是玻尔的定态轨道理论中产生矛盾的根本所在。
德布罗意用物质波概念分析了玻尔量子化条件的物理基础。根据波动的观点,同时考虑到氢原子中离散的能级,德布罗意认为氢原子中电子波沿绕原子核的圆轨道传播一周后应光滑地连接起来,这样就要求轨道的圆周长应是波长的整数倍,如图 4–8 所示。即 2πr = nλ,n = 1,2,3,…。也就是说,电子波在相应轨道上形成驻波,式中 r 是电子绕核的轨道半径,λ 是电子波的波长。利用德布罗意关系,可以得出玻尔的量子化条件 L = rp = \(\dfrac{{nh}}{{2\pi }}\) = nℏ,n = 1,2,3,…,这里 L 表示角动量。这样,我们就由物质波的驻波条件,比较自然地得出了玻尔量子化条件。
1923 年 9 月 24 日,即在发表题为《辐射——波和量子》的论文两星期后,德布罗意发表了《光学——光量子、衍射和干涉》的论文,引进了相波的概念。他预言:“一束电子穿过非常小的孔可能产生衍射现象,这也许是实验上验证我们想法的方向。”这一设想在以后的实验中得到了证实。半个月后,德布罗意又写了关于几何光学和经典力学类比的论文。1924 年德布罗意将这 3 篇论文合在一起成为他的博士论文。
德布罗意假设的正确性必须要由实验验证。如前所述,100 eV 动能的电子相应的波长在埃的数量级,这相当于 X 光的波长范围,因此,人们设想如果将电子束投射到晶体上应能看到衍射现象。戴维森和革末首先按照这一思想做了实验,并取得了成功,同时英国的 G.P.汤姆孙(发现电子的 J.J.汤姆孙的儿子)也完成了类似的电子衍射实验,这些实验完全证实了德布罗意的假设。德布罗意因提出物质波假设荣获 1929 年度诺贝尔物理学奖。而戴维森、革末和 G.P.汤姆孙则获 1937 年的诺贝尔物理学奖。
发布时间:2025/9/23 下午3:01:06 阅读次数:719
