选择性必修三 第三章 热力学定律 参考资料
1.物理学家
(1)克劳修斯
克劳修斯是德国物理学家。他主要从事分子物理、热力学、蒸汽机理论、理论力学、数学等方面的研究,特别是在热力学理论、气体动理论方面建树卓著。他是历史上第一个精确表示热力学定律的科学家。1850 年与兰金各自独立地表述了热与机械功的普遍关系——热力学第一定律,并且提出蒸汽机的理想的热力学循环(兰金—克劳修斯循环)。1850 年克劳修斯发表《论热的动力以及由此推出的关于热学本身的诸定律》的论文,他从热是运动的观点对热机的工作过程进行了新的研究。论文首先从焦耳确立的热与功之间的定量关系出发,将热力学过程遵守的能量守恒定律归结为热力学第一定律,指出在热机做功的过程中一部分热量被消耗了,另一部分热量从热物体传到了冷物体。这两部分热量和所产生的功之间存在关系:dQ = dU + dW。式中 dQ 是传递给物体的热量,dW 表示所做的功,U 是克劳修斯第一次引入热力学的一个新函数,是体积和温度的函数。后来开尔文把 U 称为物体的能量,即热力学系统的内能。论文的第二部分,在卡诺定理的基础上研究了能量的转换和传递方向问题,提出了热力学第二定律的最著名的表述形式(克劳修斯表述):热不能自发地从较冷的物体传到较热的物体。因此,克劳修斯是热力学第二定律的两个主要奠基人之一(另一个是开尔文)。
在发现热力学第二定律的基础上,人们期望找到一个物理量,以建立一个普适的判据来判断自发过程的进行方向。克劳修斯首先引入了一个新的后来被定名为熵的状态参量。利用熵这个新函数,克劳修斯证明了,任何孤立系统中,系统的熵的总和永远不会减少,或者说自然界的自发过程是朝着熵增加的方向进行的。这就是“熵增加原理”,它是利用熵的概念表述的热力学第二定律。
(2)开尔文
开尔文是英国著名物理学家、发明家,原名威廉·汤姆孙。他研究范围广泛,在热学、电磁学、流体力学、光学、地球物理、数学、工程应用等方面都作出了贡献。他一生发表论文多达 600 余篇,取得 70 种发明专利。他在当时科学界享有极高的名望,受到英国本国和欧美各国科学家、科学团体的推崇。他在热学、电磁学及它们的工程应用方面的研究最为出色。
开尔文是热力学的主要奠基人之一,在热力学的发展中作出了一系列的重大贡献。他根据盖—吕萨克、卡诺和克拉珀龙的理论于 1848 年创立了热力学温标。他指出:“这个温标的特点是它完全不依赖于任何特殊物质的物理性质。”这是现代科学上的标准温标。他也是热力学第二定律的两个主要奠基人之一(另一个是克劳修斯),1851 年他提出热力学第二定律:“不可能从单一热源吸热使之完全变为有用功而不产生其他影响。”这是公认的热力学第二定律的标准说法。并且指出,如果此定律不成立,就必须承认可以有一种永动机,它借助于使海水或土壤冷却而无限制地得到机械功,即所谓的第二种永动机。他从热力学第二定律断言,能量耗散是普遍的趋势。1852 年他与焦耳合作进一步研究气体的内能,对焦耳气体自由膨胀实验做了改进,进行气体膨胀的多孔塞实验,发现了焦耳—汤姆孙效应,即气体经多孔塞绝热膨胀后所引起的温度的变化现象。这一发现成为获得低温的主要方法之一,广泛地应用到低温技术中。1856 年他从理论研究上预言了一种新的温差电效应,即当电流在温度不均匀的导体中流过时,导体除产生不可逆的焦耳热之外,还要吸收或放出一定的热量(称为汤姆孙热)。这一现象后来叫作汤姆孙效应。
开尔文一生谦虚勤奋,意志坚强,不怕失败,百折不挠。在对待困难问题上他讲:“我们都感到,对困难必须正视,不能回避;应当把它放在心里,希望能够解决它。无论如何,每个困难一定有解决的办法,虽然我们可能一生没有能找到。”他这种终生不懈地为科学事业奋斗的精神,永远为后人敬仰。1896 年在格拉斯哥大学庆祝他 50 周年教授生涯大会上,他说:“有两个字最能代表我 50 年内在科学研究上的奋斗,就是‘失败’两字。”这足以说明他的谦虚品德。为了纪念他在科学上的功绩,国际计量大会把热力学温标(即绝对温标)称为开尔文(开氏)温标,热力学温度以开尔文为单位,是现在国际单位制中七个基本单位之一。
(3)玻耳兹曼
玻耳兹曼是奥地利物理学家。他主要从事气体动理论、热力学、统计物理学、电磁理论的研究。在这些方面他都作出了重大的贡献。他建立了熵 S 和系统宏观态所对应的可能的微观态数目 Ω(即热力学概率)的联系:S ∝ lnΩ。1900年普朗克引进了比例系数k——称为玻耳兹曼常量,写出了玻耳兹曼—普朗克公式:S = klnΩ。这样玻耳兹曼表明了函数 H 和 S 都是同热力学概率 Ω 相联系的,揭示了宏观态与微观态之间的联系,指出了热力学第二定律的统计本质:H 定理或熵增加原理所表示的孤立系统中热力学过程的方向性,正相应于系统从热力学概率小的状态向热力学概率大的状态过渡,平衡态热力学概率最大,对应于 S 取极大值或 H 取极小值的状态;熵自发地减小或 H 函数自发增加的过程不是绝对不可能的,不过概率非常小而已。
玻耳兹曼的工作是标志着分子动理论成熟和完善的里程碑,同时也为统计力学的建立奠定了坚实的基础,从而促进了热现象理论的长足进展。美国著名理论物理学家吉布斯正是在玻耳兹曼和麦克斯韦工作的基础上建立起统计力学大厦的。玻耳兹曼开创了非平衡态统计理论的研究,玻耳兹曼积分—微分方程对非平衡态统计物理起着奠基性的作用,无论从基础理论或实际应用上,它都显示出相当重要的作用。因此,人们将公式 S = klnΩ 铭刻在他的墓碑上,以纪念他在科学上的不朽功绩。
2.关于能量守恒定律建立过程的补充介绍
除了教科书详细介绍的几个人外,在独立发现能量守恒定律的众多科学家中还有英国律师出身的电化学家格罗夫、丹麦工程师格尔丁、法国的工程师赫因以及德国化学家莫尔等。法国工程师萨迪·卡诺是关于热机循环的卡诺定理的提出人。他早在 1830 年就已经认识到了“热不是别的什么东西,而是动力,或者可以说,它是改变了形式的运动”,并由此得到了一个普遍的命题:“自然界中存在的动力,在量上是不变的,准确地说,它既不能产生,也不能消灭。”他还给出了热与功之间定量关系的数值。由上述内容看,卡诺应是世界上最早发现能量守恒定律的人。遗憾的是,1832 年他死于霍乱,没有来得及发表自己的见解。直到 1878 年,他的一束遗稿被发现,这些见解才得到公开发表,可这时能量守恒定律早已确立多年了。
还有一点要提及的是,这些科学家在自己对定律的表述中,没有一个人用到“能量”这个词,都是用在当时含意比较混乱的“力”来表示能量。至于能量的概念,最早出现于英国物理学家托马斯·杨在 1807 年出版的《自然哲学讲义》一书中。书中谈到“在应用力学碰到的几乎所有情况中,对于产生运动所必要的功,并不是和力矩成正比,而是与这个功所引起的运动的能量成正比”以及“应该用能量一词来表示物体的质量或重量与速度的二次方的乘积”。不过,他的独创性见解并没有引起人们的注意,所以直到 19 世纪 30 ~ 40 年代,人们还是用“力”来表示能量,依然用“力的守恒”“活力守恒”来表示“能量守恒”。1853 年,威廉·汤姆逊(即开尔文)重新提出了“能量”概念,并给予它一个精确的定义,“我们把给定状态中物质系统的能量表示为:当它从这个给定状态无论以什么方式过渡到任意一个固定的零态时在系统外所产生的用机械功单位来量度的各种运动的总和”,这样“能量守恒定律”的称谓才逐渐被普遍接受。
3.历史上的第一类永动机举例
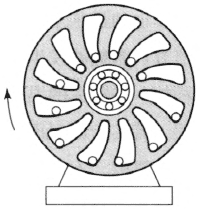
(1)文艺复兴时期意大利的达·芬奇早在 1 5世纪就提出过永动机不可能的思想。他曾设计过一种转轮(图 3–4),利用隔板的特殊形状,使一边重球滚到比另一边的距离轮心远些的地方,本以为在两边重球的作用下会使轮子失去平衡而转动不息,但试验的结果却是否定的。他从许多类似的设计方案中认识到永动机的尝试是注定要失败的。他写道:“永恒运动的幻想家们!你们的探索何等徒劳无功!还是去做淘金者吧!”
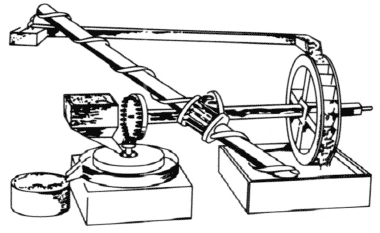
(2)流水的落差可以推动水轮机对外提供动力,能否用流水来设计永动机呢?1681 年,英国一位著名的医生弗拉德提出了一个永动机的设计方案。如图 3–5 所示,他在设计时认为,由上面水槽流出的水冲击水轮转动,水轮在带动水磨转动的同时,通过一组齿轮带动螺旋汲水器,把蓄水池里的水重新提升到上面的水槽中。他想,整个装置可以这样不停地运转下去,并有效地对外做功。实际上,流回水槽的水越来越少,很快水槽中的水就全部流进了下面的蓄水池,水轮机就停止了转动。
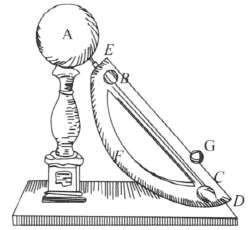
(3)大约在 1570 年,意大利有一位教授叫泰斯尼尔斯,提出用磁石的吸力可以实现永动机,名叫磁力永动机。他的设计如图 3–6 所示,A 是一个磁石,铁球 G 从 C 处受磁石吸引可沿斜面滚上去,滚到上端的 E 处,从小洞 B 处落下,经曲面 BFC 返回,复又被磁石吸引,铁球就可以沿螺旋途径连续运动下去。大概他那时不知道磁力大小是与距离的二次方成反比变化的,只要认真想一想,其荒谬处就一目了然了。
此外,人们还提出过利用轮子的惯性,细管子的毛细作用,电磁力等获得有效动力的种种永动机设计方案,但都无一例外地失败了。其实,在所有的永动机设计中,我们总可以找出一个平衡位置来,在这个位置上,各个力的作用效果恰好相互抵消掉,不再有任何推动力使它运动。所有永动机必然会在这个平衡位置上静止下来,变成不动机。
4.热力学第二定律的建立
热力学第二定律是由德国物理学家克劳修斯和英国物理学家开尔文建立的,它和热力学第一定律及热力学第三定律一起,成为研究热的动力理论的基本规律。
(1)热力学第二定律建立的历史背景
19 世纪初,蒸汽机已有很大发展,并广泛应用于工厂、矿山、交通运输,但当时对蒸汽机的理论研究还很缺乏,法国工程师卡诺在这方面作出了突出的贡献。
卡诺在 1824 年发表了《论火的动力》。他撇开一些次要的因素,由理想循环入手,研究了热机工作中的最基本因素,提出了以卡诺命名的有关热机效率的定理,明确指出:“凡是有温度差的地方,就能够发生动力”“动力不依赖于提供它的工作物质,动力的大小唯一地由热质在其间转移的一些物体的温度决定”。在证明这一定理时,他采用了热质守恒的思想和永动机不可能的原理。其实卡诺定理已内含了热力学第二定律的思想,但终究因为热质说的错误观点,没能做进一步的研究。不过可以说卡诺定理是建立热力学第二定律的先导。
1840 ~ 1847 年,热力学第一定律建立起来了。它说明热机提供的动力只依靠热质在冷、热源之间重新分配的说法是不正确的。因此,非常需要对卡诺的理论做进一步审核,把他的原理建立在新的热学理论的基础上。
1848 年,开尔文根据卡诺提出的“一切理想热机在同样的热源与冷源之间工作时,其效率相等,与使用的工作物质无关”的理论,建立了绝对温标的概念。这一温标具有一定的特点,例如,“这一温标系统中的每一度的间隔都有同样的数值”“它完全不依赖于任何特殊物质的物理性质”,因此被称为绝对温标。这种热力学温标的建立,从理论上解决了各种经验温标不一致的缺点,并为热力学第二定律的建立准备了条件。
(2)热力学第二定律建立的过程
在上述历史背景和前提条件下,克劳修斯集中大部分时间,精心研究了热力学问题,从不同角度发表了多篇文章,提出并完善了著名的热力学第二定律的克劳修斯表述。
1850 年,克劳修斯发表了《论热的动力以及由此推出的关于热学本身的诸定律》的论文,他从“热并不是一种物质,而是存在于物体的最小粒子的一种运动”的观点出发,重新考察了卡诺所提出的理论后指出,卡诺得出热量由热体向冷体传递时产生当量的功是正确的,而在由热体向冷体传递时没有热量损失是错误的。克劳修斯认为在由热做功的过程中,一部分热做了机械功,另一部分热通过从热体向冷体传递而耗散掉。克劳修斯通过一个假想的实验,得出热力学第二定律的初次表述:“在没有任何力消耗或其他变化的情况下,把任意多的热量从冷体传到热体是和热的惯常行为矛盾的。”在 1854 年发表的《力学的热理论的第二定律的另一形式》中,他将热力学第二定律的表述改变为:“热不可能由冷体传到热体,如果不因而同时引起其他关系的变化。”克劳修斯在取得一定成就后,仍继续自己的研究工作,1865 年他发表了《力学的热理论的主要方程之便于应用的形式》一文,明确地提出了熵的概念,并进一步提出了热力学第二定律的普遍表示式:\(\oint {\dfrac{{{\rm{d}}Q}}{T}} \) ≤ 0,等号适用于可逆循环,不等号适用于不可逆过程。这个式子说明熵变具有方向性,对于绝热过程,系统的熵不可能减小,这就是所谓的熵增加原理。并规定熵增加的方向为正向,熵减少的方向为负向。
1867 年,克劳修斯又发表了《关于热的动力理论的第二定律》一文,总结出一条原理:“负的转变只能在有补偿条件下发生,而正的转变即使没有补偿也能发生,或者简要地说,不需补偿的转变只能是正的转变。”
1875 年,克劳修斯在《热的动力理论》一文中,对热力学第二定律提出了更精练的说法:“热不可能自动地从冷体传到热体”或“热从一冷体转向一热体不可能无补偿地发生”。这就是大家所公认的热力学第二定律的克劳修斯表述。
同时,对热力学第二定律作出贡献的还有开尔文,他用焦耳测定做功与传热关系的实验和雷诺对蒸汽性质的观察,重新审查了卡诺定理,从热是一种粒子的运动而不是物质的观念出发,来认识热与功相互转化的过程。1851 年他发表了《论热的动力理论》,提出了两个命题:“Ⅰ.当不论借助于什么方法,从纯粹的热源得到等量的机械效应,或等量的机械效应变成纯粹的热效应而消失时,则有等量的热因之消耗或由此产生。”“Ⅱ.如果有这样一部机器,当它反过来运转时,它的每一部分的物理的和力学的动作全部倒过来,那么,它将像具有相同温度的热源和冷凝器的任何热机一样,由一定量的热产生同样多的机械效应。”接着又提出证明第二命题的一个公理:“借助无生命的物质机构,通过使物质的任何部分冷却到比周围最冷的物体的温度还要低的温度而得到机械效应,是不可能的。”他在对这一公理的注释中指出:如果公理在一切温度下都不成立,就必须承认可以有这样一种永动机存在,它借助于使海水或土壤冷却而无限制地得到机械功,即第二类永动机。以上是开尔文对热力学第二定律的原始表述,后来才逐渐演变成现在更精练的说法:“不可能从单一热源取热使之完全变为有用的功,而不产生其他影响。”这就是公认的热力学第二定律的开尔文表述。在这一表述中,明确表示热机必须工作在两个热源之间,更指出了第二类永动机不可能实现,所以具有理论意义和实践意义。
克劳修斯和开尔文虽然从不同的角度表述了热力学第二定律,但是二者是等效的。因此,通过他们的工作,反映热力学过程方向性的热力学第二定律建立起来了。
5.热力学第二定律是关于实际不可逆过程进行方向的高度概括
自然界的变化过程都是不可逆的。所谓不可逆,指的是那些自发进行的变化,不可能自发地回到原来的状态,而对外界不发生任何影响。在物理学上对可逆与不可逆过程的定义是:一个系统由某一状态出发,经过某一过程达到另一状态,如果存在另一过程,它能使系统和外界完全复原(系统回到原来状态,同时消除了系统对外界的一切影响),则原来的过程称为可逆过程;反之,如果用任何方法都不可能使系统和外界完全复原,则原来的过程称为不可逆过程。河水能从高处流向低处,这就是不可逆过程,因为水不可能自发地再从低处回到高处。这里“自发地”三个字很重要,因为我们完全可以用抽水机把水从低处抽到高处,即需要外界对水做功,于是外界发生了变化,产生了影响,这种影响是不可能消除的。这样的例子可以举出很多很多:煤炭燃烧可以放出热量,而反过来则不可能把放出的热量完全收回再变回煤炭;生命的孕育、生长、衰老、死亡,都不可能逆向进行……
可逆过程是否存在呢?应该说它只在理论上存在,只有理想的无耗散的准静态过程才是可逆的。这里的条件是:①无耗散的过程,②准静态过程。
滑动摩擦力做功是典型的耗散过程,它要消耗机械能而生热,生成的热不可能全部再转化为机械功。其他能量转化为热的过程也是耗散过程,如电流通过电阻生热等。扩散过程也是典型的耗散过程,两种气体放到一个容器内,总会均匀地混合起来,但不会再自发地分离。
准静态过程是指那种充分缓慢的变化过程,过程中的每一个状态都是热平衡态,而从一个平衡态变为另一个平衡态所需的时间都比弛豫时间长得多。凡中间态是不平衡态的过程都是非准静态过程。例如,气体自由膨胀过程中各处的压强不均匀,是力学不平衡;从高温到低温的热传导过程中各处温度不均匀,是热学不平衡;断开电源而发生自感现象的过程中,各处的电场、磁场不均匀,是电学不平衡;燃料燃烧过程中化学势不均匀,是化学不平衡,等等。这些都是非准静态过程。各种生命现象则更是远离平衡态的复杂过程。一切非准静态过程都是不可逆过程。
无耗散的准静态过程,是一种纯理想的过程,实际过程都不可能完全满足这样的条件,因此实际过程都是不可逆过程。真正的可逆过程虽然在实际中并不存在,但在热力学的理论研究中却意义重大,卡诺循环就是可逆循环。
既然实际过程都是不可逆过程,这些不可逆过程向哪个方向进行呢?热力学第二定律正是关于实际不可逆过程进行方向的高度概括。一切不可逆过程都是向着熵增加的方向进行,也就是向着能的“贬值”的方向进行。
6.热力学第二定律的两种表述是等价的
如果克劳修斯表述不成立,则开尔文表述也不成立。
证明:(反证法)如果克劳修斯表述不成立,则热量能从低温热库自动地传到高温热库。因而可以设计一种热机,工作于这两个热库之间,其工作情况如图 3–7 甲所示。T1 为高温热库,T2 低温热库。我们从高温热库吸热 Q1,向低温热库放热 Q2,同时对外做功 W。我们使 Q2 自动地从低温热库传到高温热库。经过一个循环后,总的效果是从高温热库 T1 吸取热量 Q1 – Q2,对外做功 Q1 – Q2,低温热库状态不变。这相当于是一台从单一热库吸取热量对外做功的机器,即如图 3–7 乙表示,因而违背了开尔文表述。所以如果克劳修斯表述不成立,则开尔文表述也不成立。
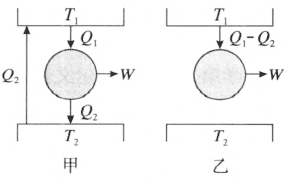
如果开尔文表述不成立,则克劳修斯表述也不成立。同样可以用“反证法”来证明。
7.生命的热力学
地球上的生命起源于 30 多亿年前,即地球形成后 10 ~ 15 亿年。按当代生物学的认识,蛋白质与核酸是生命的主要物质基础,其中蛋白质由 20 种氨基酸组成,核酸分为核糖核酸(RNA)和脱氧核糖核酸(DNA)两类,其结构单位是核苷酸。核酸控制蛋白质的合成,蛋白质的催化作用又控制着核酸的代谢活动。构成生物所需的简单有机化合物,以及较复杂的蛋白质和核酸,都于生物出现前先后在原始大气和海洋中合成了。
原始的单细胞生物在结构和功能方面逐步完善,大约到 10 亿年前开始向多细胞生物演变。海里先产生了无脊椎动物,4 亿年前有了鱼类,3.5 亿年前出现两栖类,动物开始从海洋向陆地进军。2 亿多年前以后是爬行类的世界,侏罗纪里不可一世的恐龙突然于 6 800 万年前灭绝了,哺乳动物兴旺起来,400 万年前有了原始人类。在这漫长的过程中,物种从低级进化到高级,从简单进化到复杂。可否定量化地说明物种进化的进程?当代生物学告诉我们,物种的性状是靠基因来保持和传递的,基因的信息储存在 DNA 中。我们看到,生命一开始就采取了基因的形式进化,基因中所含信息量的增长可作为物种进化的一个标志。我们知道,熵的增加代表混乱程度的增加,熵的减少代表混乱程度的减少,或有序程度的增加。信息代表有序,所以信息量的增长意味着熵的减少。
生物个体发育时,在基因里密码的指令将氨基酸联结起来,合成蛋白质。所以,一个成长起来的生物体更为有序,熵进一步减少。
再者,从食品的发酵到人们的劳作,都要生热,生命的活动是耗散过程。在耗散过程中熵不断增加,高熵意味着混乱。熵达到最大值意味着热平衡态,对于生命来说,热平衡态就是死亡。所以,要活着,有机体必须使自己的身体保持低熵的状态。
热力学第二定律告诉我们,一个封闭系统的熵只增加,不减少。所以在很长一个时期里,人们认为生命现象是与热力学第二定律相矛盾的。量子力学的创始人之一薛定谔 1943 年写过一本小册子《生命是什么?》,里面有一段名言:“生命之所以能存在,就在于从环境中不断得到‘负熵’。”他还说:“有机体是依赖负熵为生的。”薛定谔的意思是说,有机体不可能是封闭系统,必须是开放系统,它一面不断向体外排熵,一面从外界汲取低熵的物质,以形成负熵流。
我们不妨把有机体的生命过程归结为如图 3–8 所示的图解:首先再次强调,有机体必须是开放系统,它们与周围环境之间不断地有物质和能量的交流。这还不够,物质和能量的进出必须能使有机体维持低熵的状态,这就要求摄入的是低熵物质,排出的是高熵物质,用薛定谔的话说,就是负熵进,正熵出。

对于动物来说,生命攸关的低熵物质有两类:低熵高能的食物(如碳水化合物)和低熵低能的净液态水,排出的高熵物质是 CO2、水汽、尿、汗和其他排泄物。先看碳水化合物,在地球上它们来自绿色植物的光合作用。以葡萄糖为例,它在光合作用中产生的化学反应式为
\[6{\rm{C}}{{\rm{O}}_2} + 6{{\rm{H}}_2}{\rm{O}}\xrightarrow{\text{加热}}{{\rm{C}}_6}{{\rm{H}}_{12}}{{\rm{O}}_6} + 6{{\rm{O}}_2}\]
在 25 ℃ 时的熵变 ΔSmol = − 585.8J/(mol·K)。ΔSmol < 0 表示生成物(葡萄糖)是低熵的,故它可满足有机体负熵流的需求。所以阳光是地球生物圈负熵的来源。再看液态水,它具有较高的汽化热和对许多物质具有较高的溶解能力。在它蒸发或溶解了废物后变为高熵物质排出体外时,带走大量的熵。没有水就没有生命。
8.气体的绝热压缩
(1)实验器材 空气压缩引火仪,硝化棉或其他燃烧剂,橡皮吹气球等。
仪器由活塞和活塞筒组成,如图 3–9 所示,活塞包括手柄、活塞杆和橡皮活塞。活塞筒由厚壁有机玻璃制成,固定在底座上。
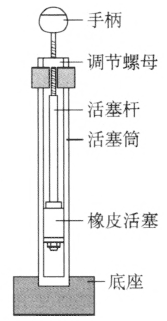
(2)实验方法
①将活塞壁涂上蓖麻油,起润滑的作用,并保证压缩过程不漏气,然后取一小片硝化棉,用玻璃棒送到活塞筒底部,再把活塞插入活塞筒上口。
②把仪器底座夹在食指和中指中间压住。右手摊开手掌,用手掌的大鱼际肌对准手柄,垂直向下用力一击,把活塞迅速地压下去,硝化棉就会在瞬间燃烧,发出明亮的火光。
(3)注意事项
①活塞筒由有机玻璃制成,不耐高温、高压。实验时,硝化棉不宜放得过多(大小如火柴头的团粒即可),以免活塞筒炸裂或烧熔损坏。
②如果第一次压缩后没有点燃,切勿再加硝化棉。应取出未燃的硝化棉,再换入新的。以防过多引起爆炸。用自制硝化棉效果较好,自制方法见说明。
③多次做实验时,可用橡皮吹气球吹气,将活塞筒底部的废气清除。待新的空气进入后再做实验。
④使用完毕,将活塞拔出,并涂上蓖麻油,与活塞筒分别放置,以免活塞长期受挤压,以致弹性衰退,发生漏气。
⑤点燃物最好不用乙醚,因乙醚对有机玻璃有溶解作用(若活塞筒由玻璃制成,则可用乙醚作点燃物)。
(4)说明 硝化棉的制法
①取小圆玻璃缸两只,一只放入半缸冷水,另一只放入半缸 32 ℃ 的温水,用来调节反应温度。
②取 100 mL 小烧杯一只,先倒入浓硝酸 10 mL,再慢慢地倒入浓硫酸 30 mL,然后把小烧杯浸在冷水缸里用玻璃棒搅拌,将混合酸的温度调节到 30 ℃ 左右。
③把 2.5 g 脱脂棉投入盛有 30 ℃ 的混合酸的小烧杯内,再把小烧杯浸在冷水缸中用玻璃棒搅拌脱脂棉,使浸有混合酸的脱脂棉处在 30 ℃ 的温度中反应,如果反应温度低于 30 ℃ 时,则把盛有混合酸和脱脂棉的小烧杯移浸到 32 ℃ 的温水缸中继续搅拌,经 15 min 后即制成硝化棉。
④把制成的硝化棉用清水反复漂去余酸并沥干,再放在通风避光处晾干后放进有干燥剂的广口瓶里备用。应避免震动和高温,以防爆炸。
发布时间:2025/9/20 上午10:13:06 阅读次数:715
