1922 年诺贝尔化学奖获得者——阿斯顿
白欣 冯晓颖 王晓义
(首都师范大学物理系;首都师范大学化学系)
摘要 在探索微观元素的过程中,同位素的发现与证明无疑具有里程碑式的意义。质谱仪的发明对证明同位素的存在功不可没,为此 1922 年的诺贝尔化学奖授予了质谱仪的发明者——F.W.阿斯顿,2010 年恰逢阿斯顿逝世 65 周年,特撰文纪念他对现代化学做出的贡献。
引发 19 与 20 世纪之交物理学革命的 3 大发现揭示了微观物质世界的秘密,通过对放射性现象的进一步研究,科学家们发现了同位素的存在。对同位素研究的需求和气体放电及阴极射线等实验研究的不断进展,最终导致了质谱仪的发明。质谱仪的发明,代表着化学元素周期律认识的新时代的到来。“这一成果的本身极为引人注目。可以清楚看出,它对整个化学科学至关紧要。
质谱仪的发明者——弗朗西斯·威廉·阿斯顿(Francis William Aston,1877—1945)是英国化学家、物理学家,长期从事同位素和质谱的研究。1919 年,他首次制成了聚焦性能较高的质谱仪,并用它对许多元素的同位素及其丰度进行了测量,肯定了同位素存在的普遍性。同时,基于对同位素的研究,他还提出了元素质量的整数法则,开创了质谱学。由此,他被授予 1922 年的诺贝尔化学奖,以表彰他“使用质谱仪发现了大量非放射性元素的同位素,并且阐明了整数法则”。

1 年轻时代
1.1 求学之路
弗朗西斯·威廉·阿斯顿,1877 年出生于英国伯明翰的哈伯纳(Harbonne),在家里的 7 个孩子中排行第三,父亲威廉姆·阿斯顿是一位金属商人,母亲法妮·夏洛特·霍里斯是伯明翰一位枪炮制造商的女儿。阿斯顿幼年在哈伯纳的一所牧师学校接受了初等教育,是学校里的优等生。之后,在莫尔文学院(Malvern College)学习了 4 年。1893 年他进入伯明翰的梅森学院(即后来的伯明翰大学)读研究生,有幸遇到了名师化学家蒂尔登(W.A.Tilden)、弗兰克兰(P.F.Frankland)和物理学家坡印亭(J.H.Poynting)。1898 年,他获得福斯特奖学金,使他有了足够的资金进行研究,在化学家弗兰克兰指导下进行了酒石酸衍生物光学性质研究,跟着弗兰克兰练就了一手“极其细致精准"的吹玻璃技术,并发表了 2 篇有机化学方面的研究论文,这为他日后的成功奠定了基础。
大学毕业后的 1900 至 1903 年间,他曾到伍尔弗汉普顿担任啤酒化学师。其间,他除了研究发酵化学外,还迷上了机械发明并且设计制造了新型抽水泵和疏散管,还在自建的小实验室里对真空放电现象进行了观察。
1903 年,阿斯顿又回到伯明翰大学,成为坡印亭的研究生,研究低压气体放电问题并用实验证明了克鲁克斯暗区的长度为 1/p + 1/。1908 年,他以氢和氦为研究对象,发现在阴极前面有很薄的一层暗区(约 1 mm,后被称为“阿斯顿暗区")。这一发现使阿斯顿显示出在实验仪器制作和实验技巧上出众的才能,受到导师坡印亭的器重。
1910 年,汤姆逊(J.J.Thomson)在用抛物线法分析阳射线时发现,一些物质的原子和分子可能具有组成质量。为了实验证明这一发现,汤姆逊要老朋友坡印亭帮助寻找一个技术高超的实验助手。坡印亭就把阿斯顿推荐给了汤姆逊。这样,阿斯顿来到了闻名世界的文迪许实验室,这成为他日后成功的重要转折点。
1.2 初试牛刀
1884 年,年仅 27 岁的汤姆逊接替物理学家瑞利(L.Rayleigh)成为卡文迪许实验室主任,汤姆逊引领卡文迪许实验室开展了一系列阳极射线与阴极射线研究。阳极射线是德国物理学家哥德斯坦(Goldstein)于 1886 年发现的,称为“极隧射线"。1898 年,德国物理学家维恩〈W.Wien)发现,某些正离子流也像阴极射线一样受磁场和静电场的影响。后来,这种从气体放电管中引出的正离子流称为阳射线。1905 年,汤姆逊开始研究阳射线。他发现把氖充入放电管做实验时,在磁场或静电场作用下,出现了 2 条阳射线的抛物线轨迹,进一步测出这 2 条抛物线所表征的粒子各带有 20 和 22 个质子质量单位。由于当时公认的氖的原子量值是 20.18,对此结果就产生了 2 种可能性解释:一是认为一条抛物线是氖的单质,另一条抛物线可能是分子量为 22 的 NeH2;另一种解释认为它们是氖的 2 种同位素(同位素概念是索迪(F.Soddy)于 1913 年提出的)。但是,汤姆逊一直坚持第 1 种解释,汤姆逊的错误判断给他的助手阿斯顿创造了机会。
当时,汤姆逊已经发明了质谱仪的雏形——从放电管射出的阳射线穿过磁场和电场时,会在水平和垂直两个方向偏斜,所有离子都以抛物线落在荧光屏上。阿斯顿来到卡文迪许实验室后,汤姆逊把改进质谱仪雏形的任务交给他,以求更准确地测定阳射线在电磁场中的偏转度,从而判定其组成和质量。在汤姆逊的指导下,阿斯顿制造了一个球形放电管和带切口的阴极,改进了真空泵,发明了检查放电管真空泄漏的螺管和拍摄抛物线轨迹的照相机,明显地提高了实验的精度。同时,他们也改进了实验方法和装置,将电场和磁场前后排列,方向相互垂直,使作用于阳射线的力平行反向。在这一实验装置中,阳射线在 2 种场的作用下,经过不同的玻璃棱镜后,分别向相反方向偏斜,然后又聚集到同一点上,使感光底片感光。由于质量不同的组分速度不同,其偏斜后的曲线曲率也不同。每一条线对应于一种离子,根据偏转的轨迹就可以测出阳射线的组分及其质量。
在研究空气时,发现除了质量为 20 单位的氖(Ne)的抛物线外,还有一条质量为 22 单位的抛物线。用冷冻法除净空气中的 CO2 后,22 单位的线仍然存在;但将空气中的氖除掉后,22 单位线和 20 单位线同时消失了。阿斯顿仔细地研读了索迪的同位素假说后,立即认为该假说是成立的。他从同位素角度推测,这 2 条线一定是氖的同位素。为确证这一推测,他先用分馏技术,后用扩散法,将组成阳射线的氖同位素进行分离,并利用他发明的精度为 10−9 g 石英晶体微大平精确测定了它们的原子量,终于证实 20Ne 和 22Ne 的存在。1913 年,在全英科学促进会的会议上,阿斯顿宣读了论文,做了实验演示,展示了 2 种氖同位素的试样,并由此而获得了麦克斯韦奖。但是,这并不能完全消除大家的疑虑,需要有一种令人信服的仪器来验证这一假说,这使得阿斯顿必须将这项工作坚持下去。
1.3 发明质谱仪
1914 年一战爆发后,阿斯顿应征人伍到隶属皇家空军的法恩巴勒(Farnborough)航空公司的航空研究所,研究用于飞机的纤维制品和涂料。同时,他一直惦记着对阳射线和同位素的研究,设想假若能发明一种测定各种元素同位素的仪器,那么他的研究就会有新突破。因此,战争刚结束,他就立刻赶回卡文迪许实验室,投入新的研究之中。
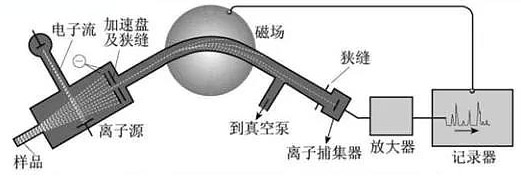
1919 年,在阿斯顿回到卡文迪许实验室不久,汤姆逊推荐卢瑟福(E.Rutherford)成为卡文迪许实验室主任。卢瑟福最早提出放射性元素的嬗变理论,也理解同位素的假说,他鼓励阿斯顿将原来的工作继续下去。阿斯顿在他原先改进的测定阳射线的气体放电装置基础上,参照了当时光谱分析的原理改进了磁分析器,设计制造出一个由离子源、分析器和收集器 3 部分组成的、可以分析同位素并测量其质量及丰度的一种新仪器——质谱仪。其原理是:同位素的物质在离子源中形成离子,经过分析器时,具有相同能量而质量不同的同位素在恒定磁场的作用下偏转不同,各循不同路径到达收集器,据它们到达收集器的位置和强度,就可求得各同位素的质量和丰度。这台质谱仪是阿斯顿从事阳射线和同位素研究的结晶,所以也称为阳射线的光谱仪。
2 质谱法的最初战果
2.1 发现同位素的普遍性
阿斯顿首先使用这一新仪器继续一战前的研究,对氖作了重新测定,并用质谱仪证明了氖确实存在 20Ne 和 22Ne 两种同位素。接着,他研究了 30 多种元素,发现它们大多数都是 2 种以上同位素的混合体,如氖、氩、氪、氙、氯都存在同位素。随后,阿斯顿使用质谱仪测定了几乎所有元素。实验结果表明,不仅放射性元素存在着同位素,而且非放射性元素也存在同位素。借助质谱仪,人们发现同位素的存在是个普遍的现象。阿斯顿在 71 种元素中发现了 202 种元素同位素。在化学研究领域,元素一直是化学研究的主要对象,自从阿斯顿发明质谱仪之后,人们发现了更加丰富的元素世界,可以说阿斯顿开创了化学元素研究的新天地。1933 年,阿斯顿在他的《质谱与同位素》(Mass Spectra and Isotopes)一书中说:“在一切已知有相当数量存在的元素里,现在只有 18 个还没有分析过”。利用质谱仪到 1935 年,人们已经知道了有 250 种稳定的同位素。
2.2 发展了普劳特假说
1907 年道尔顿提出的原子论在化学史上有着不可估量的价值,其内容包含以下假设:“同种元素的原子是相似的,在重量上是相等的”。1816 年,英国医生威廉·普劳特(W.Prout)曾提出所有的元素都是由氢原子组成,其原子量都是氢原子量的整数倍。起初,这一假说得到了化学家们的认可。然而,精确测定发现很多元素都具有非整数倍的原子量(如氯为 35.453)后,这个假说曾一度被放弃了。可是,随着门捷列夫元素周期律的提出,使每个元素赋予整数倍的相对原子量,并将元素一一排列于周期表中,这使得一些化学家又开始支持普劳特假说了。
当时,英国科学家克鲁克斯(W.Crooks)在论文“元素的产生"中提出:“所谓元素或单质实际上都是复合物,所有元素都是由一种原始物质逐步凝聚成的,但是比利时化学家斯塔(J.S.Stas)在 1860 年前后的十几年中,对原子量进行了精密测定,再次否定了普劳特的假说。门捷列夫的化学元素周期律虽已得到公认,但是在周期表中,钾和氩、钴和镍、碲和碘的排列位置却逆着原子量的大小顺序的,这是为什么?直到 20 世纪初,人们仍然不得其解。
阿斯顿运用质谱仪对众多元素所作的同位素研究,不仅指出几乎所有的元素都存在同位素,而且还证实了自然界中的元素是多种同位素的混合体。因此该元素的原子量也是依据这些同位素在自然界占据不同的比例而得到的平均原子量。例如,他发现氖是由同位素 20Ne 和 22Ne 按 10∶1 的比例组成的,所以对大量的氖原子来说,它的平均原子量是 20.2。再如,氯元素(一直被当作反驳普劳特假说的最好事例)有 2 种同位素:35Cl、37Cl,其丰度为 35Cl∶37Cl = 2∶1,所以氯的原子量既不是整数 35,也不是 37,而是 35.457。就这样,阿斯顿得出了元素的整数法则,他发现用同位素能够解释劳特的假说。
通过对同位素及其丰度的测定,阿斯顿指出氩、钾都各有 3 种同位素,它们的相对丰度分别为:36Ar∶38Ar∶40Ar = 0.31∶0.06∶99.63;39K∶40K∶41K = 93.31∶0.011∶6.68,故它们的平均原子量分别为 Ar = 39.948,K = 39.102。尽管氩的平均原子量比钾大,但是它的原子序数(即原子核的电荷数)比钾小,故门捷列夫的元素周期表是正确的,钴和镍以及碲和碘的情况也是如此。这样,阿斯顿的同位素研究又解决了一个悬案。
2.3 原子能和原子蜕变的启示
在研究中,阿斯顿发现了整数规则有一些微小的偏差。例如氢的原子量并不是 1 而是 1.008,16O 是15.9949,而 17O 是 16.99913。为什么氧的同位素不恰好是氢原子量的 16 和 17 倍?他争论说:“失掉的质量实际上并不是真正失掉了,而是按爱因斯坦的质能方程式以核的结合能的形式存在着。阿斯顿将失掉的质量除以质量数,再乘以 1 000,计算了后来称为敛集率(原子稳定性的一个量度,也是使核分裂或转变所需能量的一个量度)的量。卢瑟福 1920 年给玻尔的信中,认为阿斯顿利用质谱仪证实了原子内部存在的结合能,并认为所有元素内部都锁闭着可转换为能量的质量,并说:“如果我们能够使氢变成氦,就要失去近 1% 的质量。根据已被实验证明的质量和能量对应等式(E = mc2),释放出的能量数将是非常可观的。这样以来,一杯水中的氢变成氮所释放的能量,足以使‘皇后玛丽’号全速来回横渡大西洋。
在阿斯顿的工作中包含有关于原子能和原子蜕变的启示,他相信利用核能的可能性,也提醒人们注意核能的危险。遗憾的是,在他有生之年却看到了核能的危害——1945 年在日本爆炸了 2 颗原子弹。
阿斯顿的工作获得了科学界的认可。1920 年,他被聘为剑桥大学三一学院研究员;1921 年被选为英国皇家学会会员;1922 年荣获诺贝尔化学奖。从 1936 年到 1945 年间,他被选为国际原子化学联盟的主席。在他成名后,卢瑟福依然支持着他。卢瑟福在给同行们的信中说:“阿斯顿利用他发明的质谱仪,发现了氖、氯、汞等元素的同位素。我看到有关的所有照片,结果似乎是肯定的。阿斯顿是一个好的实验家,很有技巧,因为他拼命工作了多年,理应获得这个成功
3 严谨习惯与丰富爱好
阿斯顿有一句名言:“要做更多的仪器,还要更多地测量”。这也正是他自己一生科研生涯的写照。在荣获诺贝尔奖后,他仍然在实验室坚持工作,对质谱仪做进一步的改进和完善。1925 年制成的质谱仪的精度达到了 0.01%,到 1935 年精度已达 0.001%,到 1940 年为 0.0001%。
阿斯顿制定了严格的作息时间表,每天的生活和工作非常有规律。当在科研中遇到疑难问题时,他决不钻牛角尖,而是把疑难问题先放在一边,走出实验室或书房,在沙发上或草坪上一躺,看起小说来。他还酷爱各种体育运动,特别是游泳和滑雪,参加过摩托车比赛,32 岁时还专门到夏威夷学习冲浪。阿斯顿与卢瑟福、福勒(William A.Fowler)、泰勒(Geoffrey I.Taylor)4 人是星期天高尔夫球的老搭档。这使他使大脑得到充分休息,以利于深入思考。
阿斯顿终生独身,他的个人生活是孤独的。作为一个理论家,他承认自己难免出现失误,并经常征求数学物理学家的意见和想法,比如物理学家林德曼(F.A.Lindemann)、福勒(R.H.Fewler)和索耶尔(W.W.Sawyer)等。但他却讨厌把想法和试验与别人分享合作,是一位孤独的学者,在他一生发表的 143 篇论文中,只有 6 篇是合作完成的,这在实验科学家当中是较为罕见的。
另外,他还是一个善于投资和经营的事业家,给剑桥大学三一学院留下大笔产业。今天,剑桥大学三一学院积累的巨额资产中,有阿斯顿的一份功劳。
1945 年 11 月 20 日,阿斯顿在剑桥大学因病逝世,终年 68 岁。人们为了永远纪念他,特地把他亲手制作和发明仪器都妥善地保存下来,在不同的博物馆里展出,其中包括:在伦敦科学博物馆中保存着他在 1913 年制作的石英微天平和 1919 年制作的第 1 个质谱仪;在剑桥大学卡文迪什实验室博物馆内保存着 1913 年制作的氖碎片扩散装置和 1935 年研制的第 3 个质谱仪等。

当今,质谱仪已成为分离、分析同位素并测定它们的原子质量及相对丰度、研究鉴定各种化合物的结构、能提供化合物的分子量、元素组成以及官能团等结构信息及其反应机理的现代科学仪器。在阿斯顿之后,许多科学家们继续对质谱仪进行改良、补充和完善,使质谱仪分析法在原理上和在应用上都有了新的进展。质谱仪分析法在 20 世纪 40 年代前,主要用于气体分析和测定化学元素的同位素,以及研究一些不同元素种类中同位素的分布状况等。50 年代后,质谱仪作为一种分析仪器扩大了使用范围,用于元素原子量的测定、测定有机化合物的结构并进行有机分子鉴别,广泛用于有机化学、生物学、地球化学、核工业、材料科学、环境科学、医学卫生、食品化学、石油化工等领域以及空间技术和公安工作、地质、考古等特种分析方面。1887 年英国质谱学会为了纪念他,设立了阿斯顿奖章。可以说是质谱仪敲开了现代质谱学之门,这使我们更应当记住它的发明者——F.W.阿斯顿。
文件下载(已下载 26 次)发布时间:2023/8/21 下午7:31:47 阅读次数:5258
