选必 3 第三章 4 热力学第二定律
一滴红色颜料滴进一杯清水中扩散,整杯水将均匀地变红。从系统的角度来看,扩散之前是一种状态,扩散后是另一种状态。那么,水中扩散后的颜料能否自发地重新聚集在一起,而其余部分又变成清水?

能量守恒定律告诉我们,在自然界发生的一切过程中能量都是守恒的,一个导致能量创生或能量消失的过程是不可能出现的。然而,并不是所有符合能量守恒定律的宏观过程都能自发地进行。
无数事实告诉我们,凡是实际的过程,只要涉及热现象,如物体间的传热、气体的膨胀、扩散、有摩擦的机械运动……都有特定的方向性。这些过程可以自发地朝某个方向进行,例如,热由高温物体传向低温物体,而相反的过程,即使不违背能量守恒定律,我们也从未见到它们会自发地进行。这就是说,一切与热现象有关的宏观自然过程都是不可逆的。
在物理学中,反映宏观自然过程的方向性的定律就是热力学第二定律(second law of thermodynamics)。
热力学第二定律的克劳修斯表述 德国物理学家克劳修斯在 1850 年提出:热量不能自发地从低温物体传到高温物体。这是热力学第二定律的克劳修斯表述。
这里阐述的是热传递的方向性。在这个表述中,“自发”二字指的是:当两个物体接触时,不需要任何第三者的介入、不会对任何第三者产生任何影响,热量就能从一个物体传向另一个物体。当两个温度不同的物体接触时,这个“自发”的方向是从高温物体指向低温物体的。
热力学第二定律是用否定语句表述的(绝大多数物理定律都是用肯定语句表述的),它告诉我们什么样的过程不可能发生。
电冰箱通电后箱内温度低于箱外温度,并且还会继续降温,直至达到设定的温度。显然这是热量从低温物体传递到了高温物体。这一现象是否违背热力学第二定律呢?
在电冰箱的实例中,热量的确从低温物体——冰箱内的食品,传到了高温物体——冰箱外的空气。但是这不是自发的过程,这个过程必须有第三者的介入:必须开动冰箱的压缩机。如果不供电,冰箱的压缩机会停止工作,自发的过程则是热量从冰箱外的高温空气传向冰箱内的低温食品(图 3.4–1)。
热力学第二定律的开尔文表述 从能量的角度看,热机的工作分为两个阶段:第一个阶段是燃烧燃料,把燃料中的化学能变成工作物质的内能;第二个阶段是工作物质对外做功,把自己的内能变成机械能。
热机工作时从高温热库吸收的热量 Q,只有一部分用来做功 W,转变为机械能,另一部分热量要排放给低温热库(冷凝器或大气)(图 3.4–2)。也就是说,热机在工作过程中必然排出部分热量,热机用于做功的热量一定小于它从高温热库吸收的热量,即
\[W < Q\]
热机工作时通常会产生漏气热损、散热热损和摩擦热损等热量损失(图 3.4–3)。如果没有漏气和摩擦,也没有机体热量的损失,燃料产生的热量也不可能完全转化成机械能,工质吸收的热量不会全部变成功,例如,汽车排出
气体的温度一定会比空气的温度高,它会向空气散热。
开尔文①在分析了热机及其他涉及做功的热学过程后,于 1851 年提出了热力学第二定律的另一种表述:不可能从单一热库吸收热量,使之完全变成功,而不产生其他影响。
这里所说“不可能从单一热库吸收热量”,意思是:不仅要从一个热库吸热,而且一定会向另一个热库放热。
热力学第二定律的开尔文表述阐述了机械能与内能转化的方向性:机械能可以全部转化为内能,而内能无法全部用来做功以转换成机械能。例如,两个相互接触并做相对运动的物体,由于摩擦而静止下来,它们在这个过程中消耗的机械能可以全部转化为内能;但相反的过程不可能自发进行而不产生其他影响。
在水平地面上滚动的足球,摩擦力做负功,其动能转化为内能,最终停了下来,同时产生的热量散失在周围的环境中。会不会有这样的现象:静止在水平地面上的足球、地面和周围的空气自发地降低温度释放内能,并将释放出的内能全部转化为足球的动能,让足球又滚动起来?
上述现象是不可能发生的。问题的实质仍然是:机械能可以全部转化成内能,但这个过程是不可逆的。
可以证明,热力学第二定律的克劳修斯表述和开尔文表述是等价的。
自然界的一切变化,人类社会的所有活动,都伴随着能量的转移和转化,能量是一切物质运动的源泉,是一切生命活动的基础。
能量在数量上虽然守恒,但其转移和转化却具有方向性。在取暖照明、耕田犁地、车钻磨锻、开车驾船……各种各样的活动中,机械能、电能、光能、声能、化学能、
① 威廉·汤姆孙即开尔文。因为他在科学上的成就和对大西洋电缆工程的贡献,英女王授予他开尔文勋爵衔,后世常称他为开尔文。
核能、生物能……最终都转化成内能,流散到周围的环境中。每天我们使用的能源最后都转化成了内能,能源消耗使得周围环境升温。根据热力学第二定律,分散在环境中的内能不管数量多么巨大,它也只不过能使地球、大气稍稍变暖一点,却再也不能自动聚集起来驱动机器做功了。这样的转化过程叫作“能量耗散”。
周围环境中的内能很难再利用,而机械能、光能、化学能、电能相对于周围环境中的内能来说,可利用的品质要高。所谓能源,其实是指具有高品质的容易利用的储能物质,例如石油、天然气、煤等。能源的使用过程中虽然能的总量保持守恒,但能量的品质下降了。虽然能量总量不会减少,但能源会逐步减少,因此能源是有限的资源。
熵与熵增加原理
自然界的很多过程是不可逆的。
例如,一个容器被隔板均分为 A、B 两部分,一定量的气体处于容器 A 中,而 B 为真空(图 3.4–4)。抽取隔板 K,A 中的气体就会扩散到 B 中,最后整个容器的 A、B 两部分都均匀地分布了这种气体。这个过程显然是不可逆的。
这种不可逆的现象可以从微观角度来解释。设想开始时有 4 个气体分子分布在 A 中。如果没有隔板,对于这 4 个分子中的每一个都有两种可能性,即它处在 A 中,或处在 B 中。4 个分子共有 24 = 16 种可能的分布,如图 3.4–5 所示。
这 16 种分布中的每一种是一种微观态。在自由膨胀前,只有一个微观态,即 4 个分子都在 A 中。自由膨胀后,16 个微观态都可能实现。自由膨胀前的宏观态只包含第一个微观态,自由膨胀后的宏观态包含 16 个微观态。假定实现每一微观态的概率是相等的,则自由膨胀后回复到自由
膨胀前状态的概率为 \(\dfrac{1}{{16}}\)。
一般地说,如果 A 中气体数量为 N 个,则自由膨胀后的气体要回复到自由膨胀前的概率为 \(\dfrac{1}{{{2^N}}}\)。实际上,气体内的分子数很大,因此自由膨胀的气体要自发地回复到膨胀前的状态实际上是不可能的。
生活中我们常说到有序和无序这两个词。一副扑克牌,按黑桃、红桃、梅花、方块的顺序,而且从小到大排列,我们说它是有序的,洗牌之后有序变成了无序。当然也可以规定奇数牌在先,偶数牌在后,等等。只要确定了某种规则,符合这个规则的就是有序的。由许多张纸牌组成的系统,如果对个体的分布没有确定的要求,怎样分布都可以,我们就说这样的分布是无序的。有序与无序是相对的。
相对于膨胀后的状态,物理学中把气体膨胀前的状态叫作有序状态,而气体自由膨胀后的状态变得更混乱与无序,是无序状态。其实,把事情搞得乱糟糟的方式要比把事情做得整整齐齐的方式多得多。比如,要让操场上的一群学生按班级、身高,或按任何一种规则来站队都是比较麻烦的:组织者需要按规则来确定每个学生的位置,每个学生都要寻找自己的位置。但是,要让已经排好队的学生解散,那就非常简单,每个学生随便朝一个方向跑去,队形就乱了。从统计学的角度来解释,按一定规则排列的队形只有少数几种,而学生解散后的混乱状态有无数种。这样,混乱状态出现的概率要远大于整齐排列状态出现的概率。因此,一个系统总是自发地从有序状态向无序的混乱状态发展。
1850 年,克劳修斯首次提出熵的概念,熵可用来表达一个系统的无序程度,系统从有序向无序的发展过程中熵在增加。在物理学中,不与外界进行物质和能量交换的系统叫作孤立系统。在自发过程中,系统总是自发地向无序方向发展,即一个孤立系统的熵值总是不减少的,这就是熵增加原理。
从微观的角度看,热力学第二定律是一个统计规律:一个孤立系统总是从熵小的状态向熵大的状态发展,而熵值较大代表着较为无序,所以自发的宏观过程总是向无序度更大的方向发展。
熵的概念现在已经应用于信息学、天体物理学、生命科学、社会学等领域,在不同的学科中也有引申出的更为具体的定义。
1.汽车行驶时,要消耗汽油。尽量详尽地说明:汽油燃烧时释放的化学能通过哪些途径最终转化成了周围环境的内能。
2.以下哪些现象能够发生、哪些不能发生?能够发生的现象是否违背热力学第二定律?
(1)一杯热茶自然放置,茶会自动变得更热。
(2)蒸汽机把蒸汽的内能全部转化成机械能。
(3)桶中混浊的泥水在静置一段时间后,
泥沙下沉,上面的水变清,泥、水自动分离。
(4)电冰箱通电后把箱内低温物体的热量传到箱外高温物体。
3.一间密闭的房间里放置了一台电冰箱,为了使房间降温,有人出了一个主意,建议把冰箱接通电源,打开冰箱门,让冰箱的“冷气”进入房间中,房间就变冷了。这种方法可行吗?请说明道理。
第 4 节 热力学第二定律 教学建议
1.教学目标
(1)通过对自然界中与热现象有关的宏观过程方向性的实例分析,了解归纳热力学第二定律的过程和方法。
(2)能用热力学第二定律解释常见的不可逆过程,即自然界中的能量转化、转移以及方向性问题。
(3)了解能量与能源的区别以及能源的有限性。
2.教材分析与教学建议
热力学第二定律是关于与热运动有关的物理过程、化学过程具有不可逆性的经验总结,阐明了过程进行的方向性。教科书通过实例阐述一切与热现象有关的宏观自然过程都是不可逆的,引导学生完成对这一科学规律的认识。紧接着,教科书提出了热力学第二定律的两种表述:克劳修斯表述和开尔文表述。本节最后一部分内容阐述了能量与能源概念的区别,并指出了虽然能量是守恒的,但能源是有限的。
(1)问题引入
教科书通过创设一滴红色颜料滴进一杯清水中发生扩散现象的情境,提出该扩散现象是否可逆的问题,引发学生思考与热现象相关的宏观自然过程的方向性问题,即“从系统的角度来看,扩散之前是一种状态,扩散后是另一种状态。那么,水中扩散后的颜料能否自发地重新聚集在一起,而其余部分又变成清水?”该情境是一个典型的与热现象有关的宏观自然过程,教学中可以从这个过程的分析出发,引出一类相似性质的问题,从而提出研究这类热现象的方向性的任务。
(2)热力学第二定律
热力学第二定律是人类从自然现象的方向性研究中归纳出的重要规律。教学中要引导学生对与热现象相关的问题进行研究。我们可以用这样的思路展开教学设计:与热现象有关的宏观过程(扩散、传热、辐射等)会有特定的方向性吗?(问题)→用实例说明宏观自然过程“自发”地朝某个方向进行(证据)→判断相反的过程能否“自发”进行(归纳、推理)→过程不可逆(归纳、推理)→得到反映宏观自然过程的方向性的定律(结论)。
一个系统,由某一状态出发,经过某一过程到另一状态,如果存在另一过程,它能使系统和外界完全复原(即系统回到原来的状态,同时消除了原来的过程对外界引起的一切影响),则原来的过程称为可逆过程;反之,如果用任何方法都不能使系统和外界完全复原,则称为不可逆过程。要注意引导学生从熟悉的实例出发,思考自然界宏观过程中的可逆过程与不可逆过程。
教科书用实际案例来说明与热现象有关的宏观自然过程的方向性。例如,上述红色颜料在清水中的扩散现象是不可逆的,这说明热力学过程具有方向性。当然类似的过程是很多的:将热鸡蛋置于冷水中,热量会自发地从鸡蛋转移到冷水中,鸡蛋降温而使水温升高,这个过程不可逆;钢瓶中的压缩气体喷射到瓶外,分子的扩散运动是从密度较大的区域向密度较小的区域进行的,其逆过程不可能发生;汽缸内的压缩气体推动活塞向外运动,对外做功的同时自身的内能减少,其逆过程也不可能发生……
教学片段
与热现象有关的宏观自然过程的方向性研究
问题提出 从红色颜料在清水中的扩散现象可知,自然界的有些过程并不可逆。那么,这个规律是否具有普遍性呢?
任务分析 下列现象是否可逆:
- 轮胎里的压缩气体向外泄漏;
- 一个运动小球在有摩擦的水平面上逐渐减速停下来;
……
你有类似的例子可以提供给大家展开分析讨论吗?
归纳总结 以上例子说明了这些具有热现象本质的宏观自然过程是不可逆的。
问题提出 分析上述实例可知,与热现象有关的宏观自然过程确实不可逆。那么,没有热现象的自然过程有可逆的情况吗?我们可以进一步分析下面的问题。
解决任务 如图 3–1 所示,一个滑块在固定的光滑曲面上无初速度释放,你认为这个过程可逆吗?如果曲面与滑块之间有摩擦,则这个过程可逆吗?分析这个案例你可以得出什么结论?
归纳总结 我们发现,若滑块运动过程中没有热现象发生,则过程是可逆的;反之,则不可逆。
我们不可能穷举所有过程,但是大量事实告诉我们:一切与热现象有关的宏观自然过程都是不可逆的,这就是关于宏观自然过程的方向性问题。
①热力学第二定律的克劳修斯表述
热力学第二定律的克劳修斯表述是:“热量不能自发地从低温物体传到高温物体。”理解这个表述的关键在于理解“自发地”的含义,它的基本含义是不需要除高温物体和低温物体之外的第三者的参与。
克劳修斯的表述相当于不可能制造成这样一台机器,在一个循环动作后,只是将热量从低温物体传到高温物体,而不产生其他影响。这种机器就是不需要外界做功的制冷机。所以克劳修斯关于热力学第二定律的表述,是对制冷机工作的总结。其工作原理如图 3–2 甲所示,T1 为高温热库,T2 为低温热库,W 为外界所做的功,Q2 为从低温热库吸收的热量,Q1 为向高温热库释放出的热量。如果 W = 0,该机器在一个循环动作恢复原状后,外界也没有变化,唯一的结果是把热量 Q2 从低温热库传送到高温热库,如图 3–2 乙所示。如果能够做成这种机器,那么它的作用就等于热量自动从低温热库传送到高温热库,而外界没有任何变化。
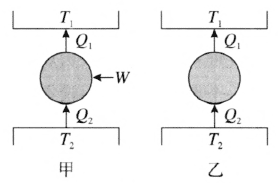
教科书选取了一个典型例子——电冰箱来说明克劳修斯表述的正确性。冰箱虽然把热量从低温的冰箱内部传到了高温的外界空气中,但这不是自发的,而是由于压缩机的工作才能做到的;如果没有电流对压缩机做功,冰箱就不可能制冷,即不能把热量从冰箱内的低温处传到冰箱外的高温处。
②热力学第二定律的开尔文表述
开尔文的表述相当于不可能制造成这样一种机器,在一个循环动作后,只是从单一热库吸收热量,使之完全变为功,而不产生其他影响。这是对热机工作的总结。其工作原理如图 3–3 甲所示,T1 为高温物体,T2 为低温物体,W 为对外界所做的功,Q2 为向低温热库散发的热量,Q1 为从高温热库吸收的热量。如果 Q2 → 0,该机器在一个循环动作恢复原状后,外界也没有变化,唯一的结果是把热量 Q1 从单一热库全部转变为功,如图 3–3 乙所示。这种效率达到 100% 的热机是不可能的。
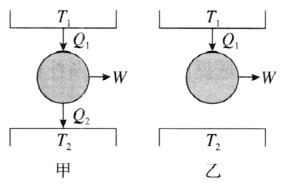
开尔文表述是建立在对热机效率的分析之上的。因此,教学中应关注学生对热机工作原理的理解,并适当引导学生分析热机的内能转化成机械能的效率。
教学片段
对开尔文表述的归纳
问题提出 热机工作时能把燃料燃烧产生的内能转化成机械能,那么,热机工作时有没有可能把内能全部转化成机械能呢?
分析论证 热机工作时由于处于温度较高的状态,必然会对周围环境(冷凝器或大气)散热。另外,热机工作时的机械摩擦也会损失一部分热量。当然,还有更重要的部分是,热机工作时需要把燃烧的废气排出,排出的废气也会带走大量的热量。因此,热机工作时不可能把燃料燃烧产生的内能全部转化成机械能。
归纳总结 根据前面的分析,请你用自己的语言归纳出一个以否定句形式表达的规律。
即任何热机都不可能把内能全部转化成机械能。也就是说,不可能从单一热库吸收热量,使之完全变成功,而不产生其他影响。
(3)能源是有限的
能量与能源是两个不同的概念。能量表示物理系统的做功本领,是运动转换本领的量度。而能源是具有高品质的容易利用的储能物质。这里必须让学生明白一个道理:可以利用能源来获得能量,但能源是有限的。虽然在使用能源的过程中能量是守恒的,但能源的使用会使能量的品质下降,导致很难再被利用了。我们使用能源的过程中,能量最后都转化成内能耗散在周围环境中,虽然能的总量保持守恒,但这些耗散的内能就很难被利用了。
3.“练习与应用”参考答案与提示
本节共 3 道习题。它们全部取材于生活,都是学生十分熟悉的经历,当然也是学生生活中可能误判的事,通过这样的练习,更有利于培养学生独立思考的习惯,加深学生对身边生活现象的再思考、再判断。第 1 题要求学生清楚其他形式的能向内能转化的过程中,必定伴随着做功的过程。第 2 题要求运用热力学第二定律对物理过程进行分析。第3题通过联系生活实际的情境,考查学生对热力学第二定律内涵的领会情况。
1.汽油燃烧时释放的化学能推动活塞做功过程中,主要通过三个途径将化学能转化为内能:一是活塞与缸体间有摩擦,摩擦力做负功,产生热量,缸体温度升高,内能增加,向周围空间散热;二是活塞压缩缸内气体做功,缸内气体温度升高,带动缸体温度升高,由于与周围环境的热交换转化为环境的内能;三是排气冲程中喷出的热气也会带走一部分热量。
2.(1)(2)不能发生,(3)(4)能够发生;不违背
提示:(1)不可能。热茶温度比周围环境温度高,热量不可能自发地从低温物体传到高温物体。
(2)不可能。蒸汽的内能转化为机械能必定需要做功,即热蒸汽推动活塞做功,这一过程中,一方面由于活塞摩擦汽缸而产生内能,另一方面热蒸汽与周围环境有温度差,蒸汽机会向周围环境散热。所以,蒸汽机把蒸汽的内能全部转化为机械能是不可能的。
(3)可能。混浊的泥水静置一段时间后,由于泥沙比水的密度大,泥沙会自动下沉,从而使得上面的浑水变清了。此过程不违背热力学第二定律,泥沙的重心降低,重力势能减少了,水的重心升高,水的重力势能增加了,但系统总的重力势能减少了,最终转化为内能,而机械能百分百地转化为内能是可能的。
(4)可能。电冰箱通电后,电冰箱内的压缩机工作,消耗电能,将热量由箱内低温物体传递到箱外高温物体。没有违背热力学第二定律,因为它是通过消耗了电能从而引起其他变化的。
3.不可行。因为电冰箱的压缩机工作后,消耗电能,才能将冰箱内空气的内能转移到冰箱外部,从而使冰箱内部的温度降低。冰箱内部减少的内能都转移到冰箱外部的环境中去了。打开冰箱门后,室内空气的内能只是被冰箱吸收后又被放出,所以室温不会降低。反而,压缩机工作时,会将一部分电能转化为内能,故室内温度会有少许升高。
发布时间:2021/1/21 下午10:45:05 阅读次数:6780
