第二章 3 气体的等压变化和等容变化
烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。用手捂住烧瓶,会观察到水柱缓慢向外移动,这说明了什么?
实验表明,在保持气体的压强不变的情况下,一定质量气体的体积随温度的升高而增大。
一定质量的某种气体,在压强不变时,体积随温度变化的过程叫作气体的等压变化。
我们可以用实验研究一定质量的某种气体在压强不变的情况下,其体积 V 与热力学温度 T 的关系。实验表明,在 V–T 图像中,等压线是一条过原点的直线(图 2.3–1)。
法国科学家盖–吕萨克首先通过实验发现了这一线性关系,这个规律可以表述为:一定质量的某种气体,在压强不变的情况下,其体积 V 与热力学温度 T 成正比,即
\[V = CT\tag{1}\]
其中 C 是常量。或者
\[\frac{{{V_1}}}{{{T_1}}} = \frac{{{V_2}}}{{{T_2}}}\]
其中 V1 、T1 和 V2 、T2 分别表示气体在不同状态下的体积和热力学温度。(1)式反映了一定质量的某种气体的等压变化规律,我们把它叫作盖–吕萨克定律(Gay-Lussac law)。
一定质量的某种气体,在体积不变时,压强随温度变化
的过程叫作气体的等容变化。
图 2.3–2 是气体等容变化时压强与温度的关系图像。从图 2.3–2 甲可以看出,在等容变化过程中,压强 p 与摄氏温度 t 是一次函数关系,不是简单的正比例关系。但是,如果把直线 AB 延长至与横轴相交(图 2.3–2 乙),把交点作为坐标原点,建立新的坐标系(图 2.3–2 丙),那么,这时的压强与温度的关系就是正比例关系了。
法国科学家查理在分析了实验事实后发现,当一定质量的气体体积一定时,各种气体的压强与温度之间都有线性关系。
可以证明,气体的压强不太大、温度不太低时,图 2.3–2 丙中坐标原点代表的温度就是热力学温度的 0 K,也称绝对零度。所以说,在 p–T 图像中,一定质量的某种气体的等容线是一条通过坐标原点的直线。这时,这个规律可以表述为:一定质量的某种气体,在体积不变的情况下,压强 p 与热力学温度 T 成正比,即 p ∝ T。写成等式的形式就是
\[p = CT\tag{2}\]
其中 C 是常量。或者
\[\frac{{{p_1}}}{{{T_1}}} = \frac{{{p_2}}}{{{T_2}}}\]
其中 p1 、T1 和 p2 、T2 分别表示气体在不同状态下的压强和热力学温度。(2)式反映了一定质量的某种气体的等容变化规律,我们把它叫作查理定律(Charles law)。
在我们的计算中,相当于大气压几倍的压强都可以算作“压强不太大”,零下几十摄氏度的温度也可以算作“温度不太低”。
【例题】
某种气体的压强为 2×105 Pa,体积为 1 m3 ,温度为 200 K。它经过等温过程后体积变为 2 m3 。随后,又经过等容过程,温度变为 300 K,求此时气体的压强。
分析 封闭容器中的气体,在状态变化中气体质量不变。气体开始时的压强、体积和温度分别为 p1、V1、T1 ,经过等温过程变为 p、V、T,再经过等容过程变为 p2、V2 、T2 。我们可以分别运用玻意耳定律和查理定律求解。
解 根据玻意耳定律,有
\[{T_1} = T,{p_1}{V_1} = pV\]
根据查理定律,有
\[V = {V_2},\frac{p}{T} = \frac{{{p_2}}}{{{T_2}}}\]
联立上述各式可得
\[\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}}\]
\[{p_2} = \frac{{{p_1}{V_1}{T_2}}}{{{V_2}{T_1}}} = \frac{{2 \times {{10}^5} \times 1 \times 300}}{{2 \times 200}}\;{\rm{Pa}} = 1.5 \times {10^5}\;{\rm{Pa}}\]
等温和等容变化后气体的压强为 1.5×105 Pa。
前面学习的等温、等压和等容三个气体实验定律都是在压强不太大(相对大气压)、温度不太低(相对室温)的条件下总结出来的。当压强很大、温度很低时,由上述规律计算的结果与实际测量结果有很大的差别。例如,有一定质量的氦气,压强与大气压相等,体积为 1 m3 ,温度为 0 ℃。在温度不变的条件下,如果压强增大到大气压的 500 倍,按气体的等温变化规律计算,体积应该缩小至 \(\frac{1}{{500}}\)m3,但是实验结果是 \(\frac{1.36}{{500}}\) m3 。但是,在通常的温度和压强下,很多实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,其性质与实验定律的结论符合得很好。
实际气体的分子之间有相互作用力,但是作用力很小;分子也有大小,但气体分子之间的间距比分子直径大得多;气体分子与器壁碰撞几乎是完全弹性的,动能损失也很小。为了研究方便,我们设想有一种气体:这种气体分子大小和相互作用力可以忽略不计,也可以不计气体分子与器壁碰
撞的动能损失。这样的气体在任何温度、任何压强下都遵从气体实验定律,我们把它叫作理想气体(ideal gas)。按照这种理想情况下得出的物理规律能很好地解释实际气体的热学性质。在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,把实际气体当成理想气体来处理,误差很小。
理想气体的状态方程
描述一定质量的某种理想气体状态的参量有三个,即压强 p、体积 V 和温度 T。等温、等压和等容三个实验定律都是研究当一个参量不变时另外两个参量的关系问题。进一步的研究结果表明,一定质量的某种理想气体,在从某一状态变化到另一状态时,尽管其压强 p、体积 V 和温度 T 都可能改变,但是压强 p 跟体积 V 的乘积与热力学温度 T 的比值却保持不变。也就是说
\[\frac{{pV}}{T} = C\]
式中 C 是与压强 p、体积 V、温度T 无关的常量,它与气体的质量、种类有关。上式叫作理想气体的状态方程。
用分子动理论可以定性解释气体的实验定律。
一定质量的某种理想气体,温度保持不变时,分子的平均动能是一定的。在这种情况下,体积减小时,分子的数密度增大,单位时间内、单位面积上碰撞器壁的分子数就多,气体的压强就增大(图 2.3–3)。这就是玻意耳定律的微观解释。
一定质量的某种理想气体,温度升高时,分子的平均动能增大;只有气体的体积同时增大,使分子的数密度减小,才能保持压强不变。这就是盖–吕萨克定律的微观解释。
一定质量的某种理想气体,体积保持不变时,分子的数密度保持不变。在这种情况下,温度升高时,分子的平均动能增大,气体的压强就增大。这就是查理定律的微观解释。
理想模型
在科学研究中,理想模型是为了便于研究问题而对研究对象进行理想化抽象的过程。实际问题往往比较复杂,影响的因素很多,直接研究它们会比较困难或几乎不能研究。科学研究中总是抓住研究对象的主要特征,忽略次要因素,对研究对象进行理想化抽象。运用这种方法,人们就可以用模型来表示研究对象,使得研究变得简单、有效,从而便于人们去认识和把握问题的本质。应该说,理想模型在现实中并不存在,但是通过它可以对实际问题进行本质探讨,并得到有价值的结论。物理学中通过抽象方法构建的理想化模型有很多,例如,质点、点电荷、单摆、弹簧振子、理想变压器、理想气体等。
1.钢瓶内装有氧气。在 17 ℃ 的室内测得钢瓶内的压强是 9.31×106 Pa;在 − 13℃ 的工地上测得钢瓶内的压强是 8.15×106 Pa。试判断该钢瓶是否漏气?为什么?
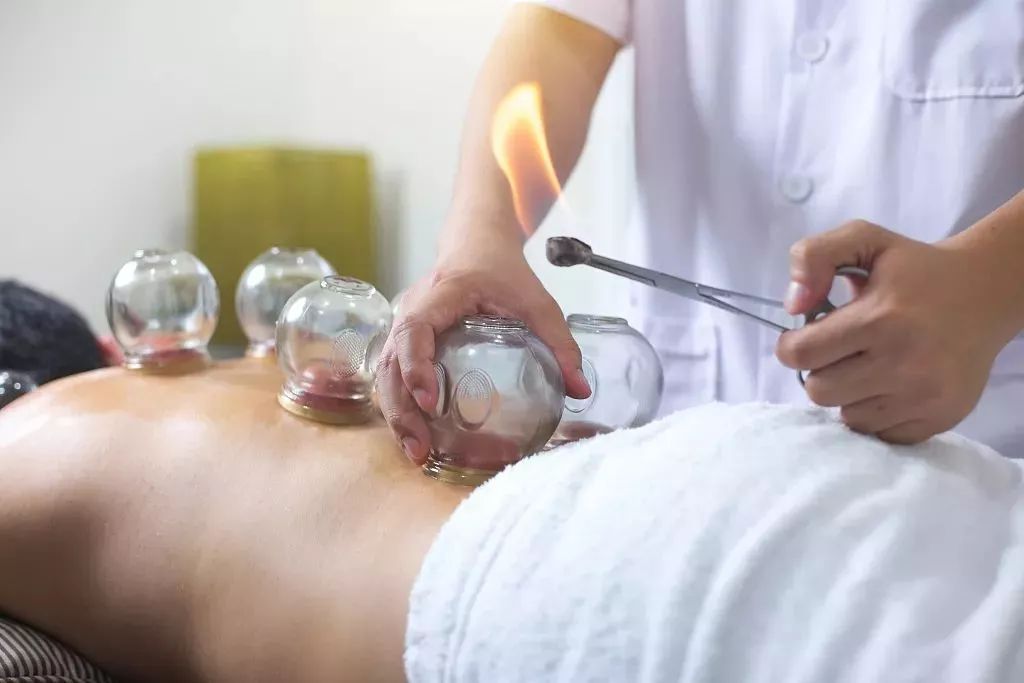
2.“拔火罐”是我国传统医学的一种治疗手段。操作时,医生用点燃的酒精棉球加热一个小罐内的空气,随后迅速把小罐倒扣在需要治疗的部位,冷却后小罐便紧贴在皮肤上(图 2.3–4)。假设加热后小罐内的空气温度为 80℃,当时的室温为 20℃,大气压为标准大气压,小罐开口部位的直径请按照片中的情境估计。当罐内空气变为室温时,小罐内的空气对皮肤的压力大概有多大?不考虑因皮肤被吸入罐内导致空气体积变化的影响。
3.如图 2.3–5,向一个空的铝制饮料罐中插入一根透明吸管,接口用蜡密封,在吸管内引入一小段油柱(长度可以忽略)。如果不计大气压的变化,这就是一个简易的气温计。已知罐的容积是 360 cm3 ,吸管内部粗细均匀,横截面积为 0.2 cm2 ,吸管的有效长度为 20 cm,当温度为 25℃ 时,油柱离管口 10 cm。若给吸管上标刻温度值,刻度是否均匀?试估算这个气温计的测量范围。
4.一个容器内部呈不规则形状,为测量它的容积,在容器上插入一根两端开口的玻璃管,
接口用蜡密封。玻璃管内部横截面积为 S,管内一静止水银柱封闭着长度为 l1 的空气柱,如图 2.3–6,此时外界的温度为 T1 。现把容器浸在温度为 T2 的热水中,水银柱静止时下方的空气柱长度变为 l2 。实验过程中认为大气压没有变化,请根据以上数据推导容器容积的表达式。
第 3 节 气体的等压变化和等容变化 教学建议
1.教学目标
(1)知道气体的等压变化,了解盖—吕萨克定律并能应用于简单问题。
(2)知道气体的等容变化,了解查理定律并能应用于简单问题。
(3)了解理想气体模型,知道实际气体在什么情况下可以看成理想气体。
(4)能用分子动理论和统计观点解释气体实验定律。
2.教材分析与教学建议
本节内容由气体的等压变化、气体的等容变化、理想气体和气体实验定律的微观解释四部分组成。气体的等压变化和等容变化的研究方法,也是在保持某个状态参量不变的情况下,研究其余两个状态参量之间的变化规律。三个规律共同构成了完整的气体实验定律体系。从宏观角度用实验的方法得到三个气体实验定律后,教科书又从微观角度用分子动理论来研究气体状态变化,并对三个气体实验定律的适用条件进行探讨,抽象出了理想气体模型。
关于理想气体模型的构建过程,教科书通过实例给出了根据实验规律计算的结果与实际情况存在差异的问题,引导学生对气体实验定律的适用条件进行探讨,再从分子动理论出发分析实际气体分子对气体状态的影响,最后抽象出理想气体模型。
(1)问题引入
教科书在本节的“问题”栏目中给学生创设了一个等压变化的实验情境。烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。水柱静止,表明烧瓶内封闭的气体压强为大气压。用手捂住烧瓶,会观察到水柱缓慢向外移动。水柱缓慢移动过程中,气体的压强可看作不变,而气体的温度和体积的变化是明显的。实验中,水柱移动的距离取决于瓶内气体温度的变化,实验时,要用双手捂住烧瓶。另外,烧瓶大小要选得合适,还可以用红墨水给水染色,以增强实验的可视性。
教学中首先要引导学生选择好研究对象,然后分析各状态参量的变化情况。学生容易忽视对压强的关注,教师要注意引导并加以分析。让学生思考:在压强不变的条件下,容器内气体的温度和体积的变化会有什么样的规律呢?
(2)气体的等压变化
对于一定质量的气体在压强不变的情况下体积与温度的关系,可以向学生介绍其探究方法,或启发学生设计探究实验方案,但也不一定都要求学生进行实验探究。教学中,可以引导学生由“问题”栏目中的实验过程,定性描述研究对象(一定质量的某种气体)在压强不变的情况下,随着温度的升高,气体的体积增大了的实验现象,猜想可能的规律。学生往往易用“热胀冷缩”来说明实验现象,教师应利用学生的前概念,进一步要求学生模仿玻意耳定律的表述,分别从研究对象、实验条件、变化规律三个方面依次进行描述,培养学生科学、严谨的表达能力。另外,还可以直接给出盖—吕萨克定律,让学生尝试根据定律内容写出对应的公式,以加深对该定律的认识,并要求学生能解释相关物理现象以及解决相关问题。
(3)气体的等容变化
介绍查理定律,要使学生了解一定质量的气体在体积保持不变时,压强与温度的关系,知道通过对等容变化的 p–T 图像“外推”所得到的气体在压强为 0 时对应温度的意义,了解“外推”也是一种科学研究方法。
对教科书中“可以证明,气体的压强不太大、温度不太低时,坐标原点代表的温度就是热力学温度的 0 K,也称绝对零度”的内容,建议不作过多的解释,但要告诉学生,这里的“可以证明”是对大量的“压强不太大、温度不太低”的不同气体做等容变化的实验数据进行分析而得出的结论。
通过数学变换,用热力学温度表述查理定律,使该规律的形式更为简洁。在此应该让学生明白,“外推”并不表示查理定律的适用范围的扩展,但“外推”得到的原点是物理学理论上的低温极限,是建立热力学温标的基础,是物理学上的重要发现。
教科书在得出三个气体实验定律之后,安排了例题教学。例题中的气体状态变化有两个过程,先等温膨胀,后等容升温。该例题属于多个过程的问题,要明确每个过程的条件,正确选用气体实验定律。在厘清解题思路和求解过程中,可以结合 p–V 图像、p–T 图像、V–T 图像进行分析,使气体状态变化的过程更加直观。
(4)理想气体
理想气体是为了研究问题方便而提出的一种理想模型,是实际气体的一种近似,就像在力学中提出的质点、电学中提出的点电荷等模型一样。理想模型的方法突出问题的主要方面,忽略次要方面,从而认识物理现象的本质,是物理学中一种常用的方法。理想气体模型的教学可以结合“科学方法”栏目展开。
实验表明,实际气体只是近似地遵从玻意耳定律、盖—吕萨克定律和查理定律。当气体压强不太大(与大气压比较)、温度不太低(与室温比较)时,实际测量的结果与上述定律得出的结果相差不大;当压强很大、温度很低时,实际测量的结果与由上述定律得出的结果有很大的差异。理想气体是不存在的,但在常温常压下,大多数实际气体,尤其是那些不易液化的气体,如氢气、氧气、氩气、氦气以及水蒸气含量不大的空气都可以近似地看成理想气体。
教学片段
理想气体模型
任务阅读 “理想气体”小节及“科学方法”栏目,回答以下问题。
- 什么是理想气体?分别从宏观和微观两个角度描述。
- 为了解释气体的热学性质,为什么要建立理想气体模型?
- 理想气体相对于实际气体,忽略了什么?为什么可以忽略?
- 结合学过的其他理想模型,总结建立理想模型的基本方法是什么?
(5)气体实验定律的微观解释
气体实验定律的微观解释,以理解气体状态参量与气体分子状态的对应关系为基础,以运用气体分子与器壁碰撞模型解释压强为核心,引导学生从微观角度来理解宏观规律,从而提高学生用宏观与微观相结合的方法来分析气体问题的能力。
一定质量的气体,分子总数是定值,体积越小,分子数密度越大;体积越大,分子数密度越小。由温度的微观含义知:温度越高,分子热运动的平均动能越大;温度越低,分子热运动的平均动能越小。由压强的微观含义知:容器中气体分子的平均速率越大、分子数密度越大,气体压强就越大;容器中气体分子的平均速率越小、分子数密度越小,气体压强就越小。解释气体实验定律的一般思路如图 2–9 所示。

3.“练习与应用”参考答案与提示
本节共 4 道习题。第 1、2 题考查查理定律的基本应用。第 3、4 题考查盖—吕萨克定律以及应用物理规律进行计算的能力。
1.该钢瓶漏气。若不漏气,气体将发生等容变化。根据查理定律 \(\frac{{{p_1}}}{{{T_1}}}\) = \(\frac{{{p_2}}}{{{T_2}}}\),应有 p2 = \(\frac{{{T_2}}}{{{T_1}}}\)×p1 = \(\frac{{273 - 13}}{{273 + 17}}\)×9.31×106 p1 = 8.35×106 Pa,而瓶中氧气的实际压强为 8.15×106 Pa,可见,该钢瓶漏气。
2.2.35×102 N
提示:加热后罐内空气的温度 T1 = 353 K,压强 p1 = p0 = 1.0×105 Pa;降温后罐内空气的温度 T2 = 293 K。由查理定律,有 \(\frac{{{p_1}}}{{{T_1}}}\) = \(\frac{{{p_2}}}{{{T_2}}}\),代入数据,解得 p2 = 0.83×105 Pa。
估计小罐半径 r = 3 cm = 3×10−2 m,面积 S = πr2 = 2.826×10−3 m2,则小罐内的空气对皮肤的压力 F = p2S = 0.83×105×2.826×10−3 N = 2.35×102 N。
3.刻度均匀;23.4 ~ 26.6℃
提示:由盖—吕萨克定律,有 \(\frac{{{V_1}}}{{{T_1}}}\) = \(\frac{{{V_2}}}{{{T_2}}}\) = \(\frac{{{V_2} - {V_1}}}{{{T_2} - {T_1}}}\) = \(\frac{{\Delta V}}{{\Delta T}}\)。
设吸管内部横截面积为 S,在25℃ 时,热力学温度为 T1,体积为 V1,油柱移动距离为 Δl,则有 \(\frac{{{V_1}}}{{{T_1}}}\) = \(\frac{{\Delta l \cdot S}}{{\Delta t}}\),即 Δt = \(\frac{{{T_1}S}}{{{V_1}}}\)Δl。
即由上式可知,Δt 与 Δl 成正比,所以吸管上刻度均匀。
封闭气体做等压变化,当油柱到达吸管与饮料罐的接口处时,气体温度最低。由盖—吕萨克定律,有 T2 = \(\frac{{{V_2}}}{{{V_1}}}\)T1 = \(\frac{{360}}{{360 + 0.2 \times 10}}\)×298 K = 296.4 K,即 t2 = 23.4℃。当油柱到达吸管管口时,气体温度最高。同理,有 T3 = \(\frac{{{V_3}}}{{{V_1}}}\)T1 = \(\frac{{360 + 0.2 \times 20}}{{360 + 0.2 \times 10}}\)×298 K = 299.6 K,即 t3 = 26.6℃。故这个温度计的测量范围是 23.4 ~ 26.6℃。
4.\(\frac{{{T_1}S{l_2} - {T_2}S{l_1}}}{{{T_2} - {T_1}}}\)
提示:封闭气体发生等压变化,设容器容积为 V0,则 V1 = V0 + Sl1,V2 = V0 + Sl2。根据盖—吕萨克定律 \(\frac{{{V_1}}}{{{T_1}}}\) = \(\frac{{{V_2}}}{{{T_2}}}\),得 \(\frac{{{V_0} + S{l_1}}}{{{T_1}}}\) = \(\frac{{{V_0} + S{l_2}}}{{{T_2}}}\),V0 = \(\frac{{{T_1}S{l_2} - {T_2}S{l_1}}}{{{T_2} - {T_1}}}\)。
发布时间:2021/1/10 下午4:42:39 阅读次数:11570
