第九章 1 固体
物理学是一场奋战,强大的对手是自然。
——约·惠勒[1]

物质是由分子组成的。分子在不停地做无规则运动,它们之间存在着相互作用力。这两种作用相反的因素决定了分子的三种不同的聚集状态:固态、液态和气态。物质处于不同状态时具有不同的物理性质。
人类对物质属性的认识是从宏观到微观不断深入的过程。应该说,人们对新材料或传统材料新功能的开发和研制从来没有停止过。从远古的石器时代,到后来的青铜器时代、铁器时代……新材料在人类文明进程中都扮演了重要的角色。
第九章 1 固体
思考与讨论
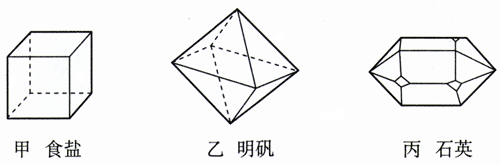
把一些常见的固体物质分为两组:一组是玻璃、蜂蜡、硬塑料等;另一组是盐粒、砂糖、石英等。
两类固体物质的外表各有什么特征?
晶体和非晶体
固体可以分为晶体和非晶体两类。石英、云母[2]、明矾、食盐、硫酸铜、蔗糖、味精等是晶体。雪花是水蒸气凝华时形成的晶体,它们的形状虽然不同,但都是六角形的图案。食盐晶体总是立方体形,明矾晶体总是八面体形,石英晶体(俗称水晶,图9.1-1)的中间是一个六棱柱,两端是六棱锥。

玻璃、蜂蜡、松香、沥青、橡胶等是非晶体。非晶体没有确定的几何形状。
蔗糖受潮后会粘在一起形成糖块,看起来没有确定的几何形状。但是用放大镜观看,仍可发现组成糖块的一个个晶体粒。粘在一起的糖块是多晶体(polycrystal),单个的晶体颗粒是单晶体(monocrystal)。
由于多晶体是许多单晶体杂乱无章地组合而成的,所以多晶体也没有确定的几何形状。常见的金属是多晶体,利用金相显微镜可以看到金属的细微结构(图9.1-3)。

晶体管、集成电路的工作与材料的微观结构有关,材料内原子的排列不能是杂乱无章的,所以制作晶体管、集成电路只能用单晶体,例如单晶硅、单晶锗。如何以较低的成本生产高纯度、大尺寸的半导体单晶体,是发展微电子工业的关键之一。

除了形状是否规则外,晶体和非晶体在物理性质上也有所不同。我们在初中已经学过,晶体有确定的熔点,非晶体没有确定的熔点,这就是区别之一。此外,其他物理性质也有差异。
根据单晶体与多晶体的区别,你认为多晶体是否会有确定的熔点?
实验
把熔化了的蜂蜡薄薄地涂在薄玻璃片上。把一枝缝衣针烧热,然后用针尖接触蜂蜡层的背面,不要移动,观察蜂蜡熔化区域的形状(图9.1-5甲)。

把玻璃片换成单层云母片,再做以上实验。
在玻璃片上和云母片上,蜂蜡熔化区域形状的不同说明了什么?
有些晶体沿不同方向的导热或导电性能不同;有些晶体沿不同方向的光学性质不同。这类现象称为各向异性(anisotropy)。非晶体沿各个方向的物理性质都是一样的,这叫做各向同性(isotropy)。
由于多晶体是许多单晶体杂乱无章地组合而成的,所以多晶体是各向同性的。
思考与讨论
通过晶体呈现的特殊物理性质,你认为晶体在微观结构上可能有什么特点?
晶体的微观结构
为什么晶体的形状和物理性质会与非晶体不同?人们认为很可能是它们的微观结构不一样。从17世纪到19世纪,陆续出现了一些假说,认为各种晶体内部的微粒是按各自的规则排列着的,但是由于当时检测技术的限制,缺少实验证据,所以这些想法只能是假说。
到了20世纪初,通过X射线在晶体上衍射的实验,这种假说才得到证实。在20世纪70年代,人们又用电子显微镜观察到了铀、钍原子的像。到了1982年,扫描隧道显微镜的问世,使人类第一次观察到原子在物质表面的排列状况。
关于晶体对X射线的衍射,《选修3-4》中会有粗浅的描述。
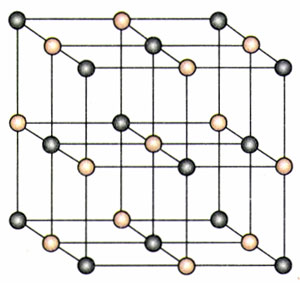
在各种晶体中,原子(或分子、离子)都是按照一定的规则排列的,具有空间上的周期性。图9.1-6是食盐晶体中氯离子和钠离子分布的示意图。
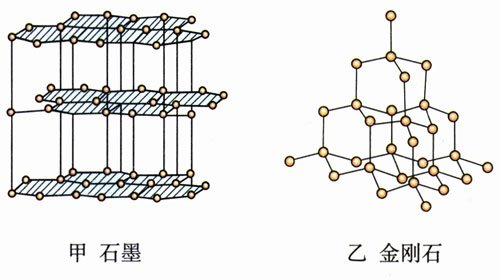
有的物质在不同条件下能够生成不同的晶体。那是因为组成它们的微粒能够按照不同规则在空间分布。例如,碳原子如果按图9.1-7甲那样排列,就成为石墨,而按图9.1-7乙那样排列,就成为金刚石。石墨是层状结构,层与层之间距离较大,原子间的作用力比较弱,所以石墨质地松软,可以用来制作粉状润滑剂;金刚石中碳原子间的作用力很强,所以金刚石有很大的硬度,可以用来切割玻璃。
原子(或者分子、离子)并不是在图9.1-6和图9.1-7所画的那些点上静止不动。它们在不停地振动,图中所画的那些点,是它们振动的平衡位置。
同种物质也可钱以晶体和非晶体两种不同的形态出现,也就是说,物质是晶体还是非晶体,并不是绝对的。例如,天然水晶是晶体,而熔化以后再凝固的水晶(即石英玻璃)就是非晶体。有些非晶体在一定条件下也可以转化为晶体。
科学漫步
一、“越小物质”的秘密
纳米(nanometer)是长度的单位。1 nm=10-9 m,也就是说,一纳米相当于十亿分之一米,它只有头发直径的十万分之一,肉眼无法分辨。纳米科学技术的研究对象就是尺寸处在1~100 nm之间的物质世界,纳米材料是纳米科学技术重要的组成部分。
什么是纳米材料呢?我们知道,物质是由原子、分子等微粒组成的,它们按一定规律组成一个个小单元,这些小单元结合在一起形成了肉眼可见的物体。对于通常材料来说,分子等微粒按一定规律组成的小单元仍然包含着成千上万个原子、分子等。用机械的方法把物质粉碎、研磨,可以得到很细的粉末,但实际上一粒这样的粉末仍比这里说的“小单元”大得多。
如果用化学的方法,使组成物质的每个小单元只包含几个,至多几十个原子、分子,直径只有1~100 nm,就会发现,这样的物质有很多新的特性。例如,通常的金块呈黄色,但是10 nm的金颗粒组成的金块却是绿色的,而1 nm的金颗粒组成的金块是红色的!通常说的纳米材料,指的就是直径1~100 nm的颗粒或直径1~100 nm的细纤维构成的材料。
录音带、录像带、磁卡、计算机磁盘等都采用磁性颗粒作为磁记录介质。磁性纳米微粒尺寸小,因此,用纳米磁性材料制造的磁记录器件,单位面积就可以记录更多的信息,记录密度大大提高。此外,由于一个纳米微粒就可能是单个的磁畴,所以纳米磁记录材料的矫顽力很高,可以大大提高信噪比,改善记录质量。
某些纳米颗粒组成的物质对光的吸收作用大大增强。在感光材料、有机颜料、光电导休等方面,如果应用纳米材料,效能会有极大的提高。
在力学性能方面,纳米金属材料、纳米陶瓷材料及纳米复合材料等也具有很多奇特的性能,例如纳米陶瓷的韧性比普通陶瓷强,因而不易破碎。
纳米材料还会改变材料的表面活性和生物活性。用某些纳米材料制造冰箱和洗衣机的内壁,微生物不易在表面生存,从而不留异味、易于清洗。纳米材料在催化剂和医用材料方面也有广阔的应用前景。
人类在探索微小物质世界的进程中还在不断地进取着。
二、能“记忆”形状的合金
1932年,瑞典人奥兰德在金镉合金中首次观察到“记忆”效应,即当这种合金的形状改变后,一旦加热到一定的温度,它又会恢复原来的形状。人们把这种合金称为形状记忆合金。
为什么会有形状记忆效应?原来这种合金的晶体结构能随温度变化。假设它的单位晶体结构为立方体,当温度降低时,其微观结构发生变化,成菱形块。当然,这样的微观变化用肉眼是看不出来的。在温度升高后,单位晶体结构恢复为立方体,各单位晶体结构之间的相对位置也都复原。合金的宏观形状也恢复为原来的形状。若在温度较高时用这种合金制作一条金属棒,在低温时用力将它弯曲,当温度升高时,整体形状又变成直棒。
目前形状记忆合金已经在许多领域得到应用。例如,人造卫星上的揽物面天线可以用记忆合金制作。发射之前,将天线折叠起来装进星体,当人造卫星到达预定轨道后,只需加温,折叠的天线因具有记忆功能而展开,恢复抛物面的形状。
再如,钛镍合金的生物相容性很好,利用其形状记忆效应可以固定断骨。使用步骤大致如下。
先按以后的使用温度(例如人的体温37℃)下需要的形状制造合金夹骨板,安装则在较低温度(0~5℃)下进行。这时可以把夹骨板变成便于操作的形状。当温度升高至人体温度时,它便自行恢复至设定的形状,同时产生适当的形状恢复力。除了夹骨板外,医学应用实例还有很多,如血栓过滤器、脊柱矫形棒、牙齿矫形丝、脑动脉瘤夹、髓内针、人工关节等。
还有一种记忆合金,在较低温度下是一种形状,加热后变成另一种形状,冷却后又能恢复低温时的形状。这样的合金在加热和冷却这样两个过程中具有形状记忆功能,因此有更广泛的应用。
问题与练习
1.有一块物质薄片,某人为了检验它是不是晶体,做了一个实验。他以薄片的正中央O为坐标原点,建立xOy平面直角坐标系,在两个坐标轴上分别取两点x1和y1,使x1和y1到O点的距离相等。在x1和y1上分别固定一个测温元件,再把一个针状热源放在O点,发现x1点和y1点的温度在缓慢升高,但两点温度的高低没有差异。于是得出结论,这块薄片是非晶体。
请你说明:以上实验结论的形成,存在着什么科学性问题?
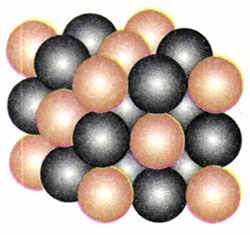
2.食盐晶体由钠离子和氯离子组成,如果用圆球来表示离子,食盐晶体的结构可以用图9.1-8表示。图9.1-6是食盐中钠离子和氯离子空间分布的示意图,那个图把相邻离子的中心用线连接起来,组成了一个个大小相等的立方体。现在要估算相邻两个钠离子中心的距离,除了知道食盐的密度ρ=2.17×103 kg/m外,还要知道哪些数据?请用字母表示这些已知数据,推导出相邻两个钠离子中心距离的表达式。
提示:图9.1-6中立方体的个数与离子数目相等。
3.内陆盐矿中开采的氯化钠称为岩盐,岩盐的颗粒很大,我们能清楚地看出它的立方体形状。把大颗粒的岩盐敲碎后,小颗粒的岩盐仍然呈立方体形状。
图9.1-9表示岩盐晶体的平面结构:红点为氯离子,灰点为钠离子,如果把它们用直线连起来,将构成一系列大小相同的正方形。作分界线AA1,使它平行于正方形的对角线,作分界线BB1,使它平行于正方形的一边。在两线的左侧各取一个钠离子:M和N,为了比较这两个钠离子所受分界线另一侧的离子对它作用力的大小,分别以M、N为圆心,作两个相同的扇形,不考虑扇形以外远处离子的作用。
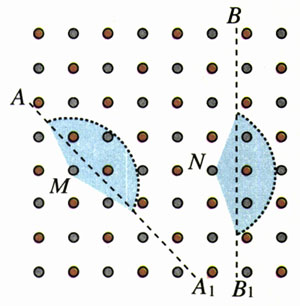
(1)如果F表示两个相邻离子之间引力的大小,问:M、N所受扇形范围内的正负离子对它作用力的合力是F的多少倍?为使问题简化,设所有离子都是质点,而且它们相互作用遵从平方反比规律。
(2)根据计算结果解释:为什么敲碎的岩盐总是呈立方形状,而不会沿图中AA1分界线断开?
实际晶体中的作用力要复杂得多,但这里的分析对理解自然现象还是有用的。
[1] 约·惠勒(John Wheeler,1911~ ),美国普林斯顿大学教授,理论物理学家,“黑洞”等名词的创造者。
[2] 云母是一种矿物,化学成分为铝硅酸盐,可以剥成一片片的薄层。有些云母的绝缘性能很好,在过去没有塑料的年代,云母常在电器中用做绝缘物。
发布时间:2017/5/24 上午8:13:52 阅读次数:2298
