第八章 3 理想气体的状态方程
理想气体
玻意耳定律、查理定律、盖-吕萨克定律等气体实验定律,都是在压强不太大(相对大气压强)、温度不太低(相对室温)的条件下总结出来的。当压强很大、温度很低时,上述定律的计算结果与实际测量结果有很大的差别。例如:有一定质量的氦气,压强与大气压相等,体积为1 m3,温度为0℃。在温度不变的条件下,如果压强增大到大气压的500倍,按玻意耳定律计算,体积应该缩小至\(\frac{1}{500}\)m3,但是实验结果是\(\frac{1.36}{500}\)m3。如果压强增大到大气压的1 000倍,体积实际减小至\(\frac{2.07}{1000}\)m3,而不是按玻意耳定律计算得到的\(\frac{1}{1000}\)m3。
尽管如此,很多实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,在通常温度和压强下,其性质与实验定律的结论符合得很好。为了研究方便,可以设想一种气体,在任何温度、任何压强下都遵从气体实验定律,我们把这样的气体叫做理想气体(ideal gas)。在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,把实际气体当成理想气体来处理,误差很小,可是计算起来却简便多了。
理想气体的状态方程
描述一定质量的某种理想气体状态的参量有三个:p、V、T。前面提到的每一个实验定律所谈的,都是当一个参量不变时另外两个参量的关系。这节我们将研究三个参量都可能变化的情况下,它们所遵从的数学关系式。
思考与讨论
如图8.3-1,一定质量的某种理想气体从A到B经历了一个等温过程,从B到C经历了一个等容过程。分别用pA、VA、TA和pB、VB、TB以及pC、VC、TC表示气体在A、B、C三个状态的状态参量,请同学们尝试导出状态A的三个参量pA、VA、TA和状态C的三个参量pC、VC、TC之间的关系。
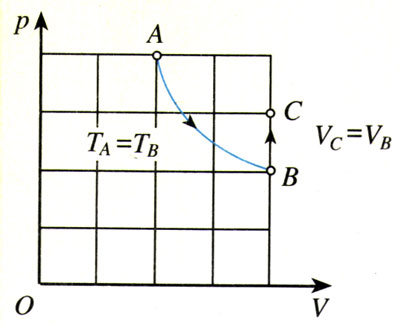
推导过程中要注意:
1.先要根据玻意耳定律和查理定律分别写出pA、VA与pB、VB的关系及pB、TB与pC、TC的关系;
2.由于要推导A、C两个状态之间的参量的关系,所以最后的式子中不能出现状态B的参量。为此,要在写出的两式中消去pB,同时还要以TA代替TB(因为A→B是等温过程,两个状态的温度是相等的)、以VC代替VB(因为B→C是等容过程,两个状态的体积是相等的)。
在图8.3-1所示的两个过程中,把A→B的玻意耳定律方程和B→C的查理定律方程联立,消去两个方程中状态B的压强,便得到关系式
\(\frac{{{p_{\rm{A}}}{V_{\rm{A}}}}}{{{T_{\rm{A}}}}}\)=\(\frac{{{p_{\rm{C}}}{V_{\rm{C}}}}}{{{T_{\rm{C}}}}}\)
这里A、C是气体的两个任意状态。上面的式子表明,一定质量的某种理想气体,在从状态1变化到状态2时,尽管其p、V、T都可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变。也就是说
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\) (1)
或
\(\frac{{pV}}{T}\)=C (2)
式中C是与p、V、T无关的常量。
上面两式都叫做一定质量的某种理想气体的状态方程(state equation of ideal gas)。
【例题】一定质量的某种理想气体由状态A变为状态D,其有关数据如图8.3-2所示。若状态D的压强是104 Pa,状态A的压强是多少?
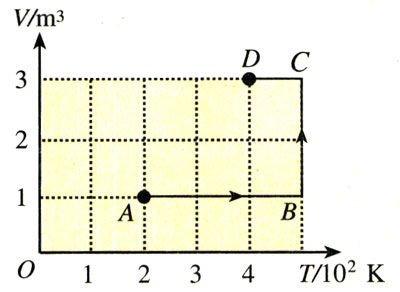
【解】从题目所给的条件可以看出,A、D两个状态中共有5个状态参量是已知的
VA=1 m3,TA=200 K,
VD=3 m3,TD=400 K,pD=104 Pa
待求的状态参量是pA。
根据题意,研究的对象是一种理想气体,而且质量是一定的。由理想气体状态方程把这些状态参量联系起来,即
\(\frac{{{p_{\rm{A}}}{V_{\rm{A}}}}}{{{T_{\rm{A}}}}}\)=\(\frac{{{p_{\rm{D}}}{V_{\rm{D}}}}}{{{T_{\rm{D}}}}}\)
由此解出
pA=\(\frac{{{p_{\rm{D}}}{V_{\rm{D}}}{T_{\rm{A}}}}}{{{V_{\rm{A}}}{T_{\rm{D}}}}}\)
代入数值后得到状态A的压强
pA=\(\frac{{{{10}^4} \times 3 \times 200}}{{1 \times 400}}\) Pa=1.5×104 Pa
用图象可以清晰、直观地描述气体的状态参量和变化过程。
从这个例题可以看出,一定质量的理想气体的状态方程给出了两个状态间的联系,并不涉及气体从一个状态变到另一个状态的具体方式。
问题与练习
1.对一定质量的气体来说,能否做到以下各点?
(1)保持压强和体积不变而改变它的温度。
(2)保持压强不变,同时升高温度并减小体积。
(3)保持温度不变,同时增加体积并减小压强。
(4)保持体积不变,同时增加压强并降低温度。
2.某柴油机的气缸容积为0.83×10-3 m3,压缩前其中空气的温度为47℃、压强为0.8×105 Pa。在压缩冲程中,活塞把空气压缩到原体积的\(\frac{1}{17}\),压强增大到40×105 Pa,求这时空气的温度。
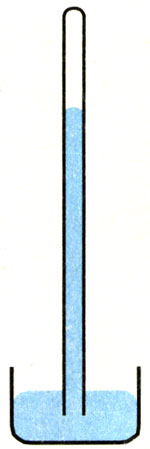
3.在做托里拆利实验时,玻璃管内有些残存的空气,此时玻璃管竖直放置,如图8.3-3。假如把玻璃管竖直向上提起一段距离,玻璃管下端仍浸在水银中,则管内空气体积如何变化?管内水银柱长度如何变化?管内空气压强如何变化?
发布时间:2017/5/22 下午2:14:22 阅读次数:3794
