第2章 六、理想气体的状态方程
前面我们已经学习了用控制变量的方法,研究一定质量的气体在体积不变时(等体积过程),它的压强跟温度的关系,压强不变时(等压过程),它的体积跟温度的关系,以及在温度不变时(等温过程),它的压强跟体积的关系,并且分别得出查理定律、盖·吕萨克定律和玻意耳定律。但在实际情况中,经常会遇到气体的温度、体积和压强这三个量中,有一个量发生变化时,会引起其他两个量同时发生变化的复杂情况。例如四冲程柴油机压缩冲程开始后,进气阀和排气阀就都关闭,这时活塞把已经吸入气缸的一定质量的空气压缩,气缸内空气体积迅速减小的同时,它的温度和压强都急剧地增大,到压缩冲程末,当气缸内空气体积减小为原来体积的\(\frac{1}{{20}}\)时,温度可升高到700℃,压强可高达4×106帕,这时向气缸内喷入雾状燃油,燃油立即燃烧。再如图2-27(a)所示的竖直放置的U形管中,封闭端内有一定质量的气体,当气体温度升高时,它的体积膨胀了,压强也一定相应增大[图2-27(b)]。
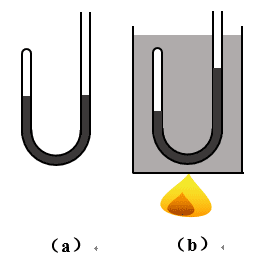
怎样研究一定质量气体的温度、体积和压强三个量同时发生变化的情况呢?它们在发生变化的过程中,是否也具有某种规律呢?
理想气体
气体的三个实验定律是研究上述情况的基础,但它们都是在温度不太低、压强不太大(相对于室温和通常的大气压强)的情况下得出的。如果在温度很低、压强很大的情况下,实验结果将会出现很大偏离,而且在温度非常低、压强非常大时,真实气体可能已经变成液态甚至变成固态了。为了便于研究问题,我们可以设想一种气体模型,这种气体在任何温度和压强下,都将严格遵循上述研究气体热学性质的实验定律,这种气体叫做理想气体。
物理模型
物理学是研究物质运动最一般的规律和物质的基本结构的科学。在实际情况中,影响物质运动变化的因素往往是复杂的。为了简化问题,有利于所研究的问题的逐步展开和顺利解决,在物理学研究中常常忽略一些次要因素,而只考虑起决定作用的主要因素,因此,就需要建立物理模型。
例如把物质分子看成一个个不连续的弹性小球,在物质三态中有着不同的空间分布与结构,这就是物质结构的分子模型。
为便于研究真实气体的性质,建立了理想气体模型,并假设它有如下性质:
1.分子之间除碰撞外,不存在分子作用力。
2.分子只有质量而无体积,理想气体可以无限压缩。
这些假设使在研究真实气体时能抓住气体的主要性质与特征,忽略在低温、高压下跟气体实验定律之间出现的偏离,从而使研究的问题得以简化。
建立物理模型是一种科学方法,在今后学习中经常用到。
理想气体状态方程
如图2-28(a)所示,在一个带有活塞的竖直放置的容器里,盛有一定质量的理想气体,它的温度为T1,体积为V1,压强为p1,这是它的一个平衡状态,设为状态1。
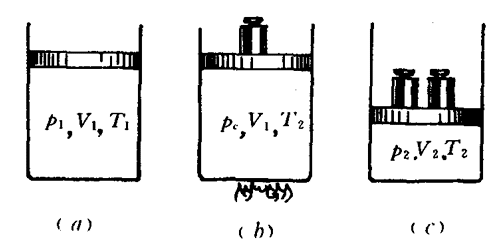
如果要使它变化到另一个平衡状态2,这时的温度为T2(T2>T1),体积为V2(V2<Vl),压强为p2(p2>p1)[图2-28(c)]。设想这一定质量的气体是先后经过两个过程来实现这一状态变化的。假定它先经过一个等体积过程,到达某一个中间状态C,这时的温度TC=T2,体积保持不变VC=V1,压强为pC。[图2-28(b)]。根据查理定律,可得出在这过程中压强跟温度的关系是
\(\frac{{{p_1}}}{{{p_C}}}\)=\(\frac{{{T_1}}}{{{T_2}}}\) (1)
然后使气体再经过一个等温过程到达状态2,这时温度仍为T2,体积为V2,压强为p2[图2-28(c)]。根据玻意耳定律,可得出这过程中压强跟体积的关系是
p1V1=p2V2。 (2)
从(1)式得pC=\(\frac{{{p_1}{T_2}}}{{{T_1}}}\),代入(2)式,整理后得
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\)。
这个方程叫做理想气体状态方程。表明一定质量的理想气体的压强和体积的乘积,除以它的热力学温度得到的商,在状态变化过程中是保持不变的。即
\(\frac{{pV}}{T}\)=C(常数),
式中C跟气体的质量和性质有关。理想气体状态方程反映了一定质量理想气体的温度、体积和压强这三个状态量间的关系,对于真实气体来说,在温度不太低、压强不太大的情况下也是适用的。
理想气体的状态方程实际上包含了前几节所学过的气体实验定律。例如温度不变时(T1=T2),理想气体状态方程就是玻意耳定律的表达形式;体积不变时(V1=V2),理想气体状态方程就是查理定律的表达形式;压强不变时(p1=p2),理想气体状态方程就是盖·吕萨克定律的表达形式。
在应用理想气体状态方程解决实际问题时,要注意气体的质量必须是一定的,气体先后所处的两个状态的压强和体积应分别取相同的单位,而温度则必须用热力学温度表示。
【例题】
如图2-29所示,两个容积相等的容器A和B,用一细管相连,关闭阀门S,将容器B抽成真空。容器A中有一定质量的气体,压强为1.0×105帕,温度为27℃。打开阀门S,一部分气体将从容器A进入容器B。如果两个容器中的气体温度都降低到10℃,这时容器A内的气体压强是多大?
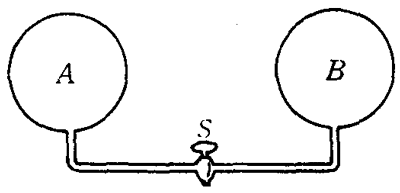
【解】容器A中一定质量气体初始状态的体积设为V1,温度T1=(273+27)开,压强p1=1.0×105帕。阀门S打开后,气体体积增大为V2=2V1,温度降低为T2=(273+10)开。达到平衡后,容器A内的气体压强与容器B中的气体压强是相等的,设为p2。
根据理想气体状态方程
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\)
得 p2=\(\frac{{{p_1}{V_1}{T_2}}}{{{V_2}{T_1}}}\)=\(\frac{{1.0 \times {{10}^5} \times {V_1} \times (273 + 10)}}{{2{V_1} \times (273 + 27)}}\)帕=\(\frac{{283}}{{600}}\)帕=0.47×105帕。
即容器A内的气体压强为0.47×105帕。
可见,容器中气体压强比原来减小一半还多。这是因为气体体积增大到原来2倍的同时,气体的温度也降低的缘故。
问题探讨
 S:一定质量的理想气体在状态变化时,是否可能温度升高体积反而减小?如果可能的话,跟盖·吕萨克定律是否相矛盾?
S:一定质量的理想气体在状态变化时,是否可能温度升高体积反而减小?如果可能的话,跟盖·吕萨克定律是否相矛盾?
T:一定质量的理想气体在状态变化时,温度升高,只要压强同时增大,体积减小是有可能的。如内燃机在压缩冲程中,气缸内气体的情况就是这样。这跟盖·吕萨克定律并不矛盾,因为盖·吕萨克定律是在气体压强不变的条件下(即等压过程中)才适用,而你假定的状态变化是p、V、T三个量都在发生变化的。
练习七
1.一个沼气泡从池塘底升起到达水面。若已知池水深5米,池底温度为17℃,水面温度为27℃,大气压强为1.0×105帕。这一沼气泡自池底升到水面时体积增大为原来的几倍?
2.某一内燃机吸入气缸的燃料混和气的压强为1.0×105帕,温度为47℃。在压缩冲程末,气缸内混和气的压强达到1.2×106帕,压缩前、后混和气的体积之比是6∶1,压缩后气缸内混和气的温度升高到多少摄氏度?
3.如图2-30所示,气缸总容积为20升,内有一个面积为0.04米2的绝热活塞,把气缸分隔成两部分。开始时,活塞左、右两侧空气的温度、压强、体积都相等,活塞在气缸的正中央恰保持平衡。现使气缸内活塞左侧空气温度升高到47℃,活塞右侧空气温度降低到0℃,试求活塞最终平衡时的位置。
4.某一定质量的理想气体在状态1时的温度为T1,体积为V1,压强为p1。如果先让它经过一个等温压缩过程,到达某一中间状态C,使压强增大为p2,体积减小为VC;再经过一个等压膨胀过程,到达状态2,使它的温度升高为T2,体积增大为V2。试利用有关的气体实验定律推导出理想气体的状态方程。
文件下载(已下载 198 次)发布时间:2016/11/10 上午10:23:54 阅读次数:7115
