第七章 D 理想气体的状态方程
在海底巡航的潜艇,必须有上升到海面上的功能。潜艇上浮或下沉主要是靠艇内的水舱,舱内水面上部的空气与贮有压缩空气的贮气筒相连。潜艇若要上浮到海面,需要把筒内压缩空气压入水舱,把水舱中的水“赶”到大海中去,以减轻艇的“体重”,这样,潜艇便可上浮。如果潜艇要下沉,则需打开水舱两侧阀门,让海水进入水舱,并把空气压回贮气筒。

贮气筒内的压缩空气在水面和在水底时的压强、体积、温度都有变化。那么,这三个物理量的变化遵循什么规律呢?
一、理想气体模型
在基础型课程中,我们已经探讨过气体的实验定律。我们把能够严格地遵循气体实验定律的气体,叫做理想气体。从微观上讲,理想气体是完全忽略分子本身体积大小、完全不计分子之间相互作用力的气体。
一定质量的气体,如果温度越高、压强越小,气体就越稀薄,气体分子间距离就越大,就越接近理想气体。在温度较低、压强较大的情况下,气体不再稀薄,研究气体性质时必须考虑到分子的大小和分子间的相互作用,跟气体定律之间出现了较大的偏离,这就是必须在温度不太低、压强不太大的条件下,真实气体才能基本上遵循气体的实验定律的微观解释。
理想气体是一种理想化的物理模型,在通常温度和压强下,真实气体的性质近似于理想气体。
二、理想气体状态方程
当气体的状态发生变化时,它的状态量p(压强)、V(体积)、T(温度)往往都发生变化。现在就来研究一定质量的理想气体在状态变化中,各个状态量的变化规律。
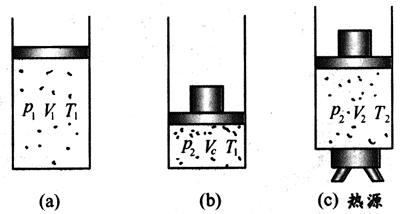
设想在有活塞的容器内的一定质量的理想气体,在状态1时其状态量分别为p1、V1、T1[图7-37(a)];经过等温变化到中间状态c,状态量分别为p2、Vc、T1[图7 - 37(b)];再经过一个等压变化过程到状态2,其状态量分别为p2、V2、T2[图7-37(c)]。图7-38是容器内一定质量气体状态变化的p-V图线。
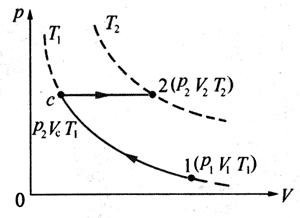
对于第一个等温过程,可根据玻意耳定律得到
p1V1=p2Vc。
对于第二个等压过程,可根据盖·吕萨克定律得到
\(\frac{{{V_c}}}{{{T_1}}}\)=\(\frac{{{V_2}}}{{{T_2}}}\)
在以上两个式子中消去Vc,可得
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\)
这就是理想气体的状态发生变化时各状态量之间的关系式,通常叫做理想气体的状态方程,简称气态方程。对于一定质量的理想气体来说,\(\frac{{pV}}{T}\)的值是个常数,即
\(\frac{{pV}}{T}\)=C。
自主活动
通过等容过程和等温过程推导出气态方程。
示例1
有一个氢气球,在球内气体压强为1.0×105Pa、温度为20℃时的体积是8m3。气球上升到高空后,在球内气体压强为0.7×105Pa、温度为-50℃的条件下,该氢气球的体积有多大?
【分析】氢气球内的氢气在常压、常温下可以看作是理想气体。根据题意,其初状态的状态量分别是:p1=1.0×105Pa,V1=8m3,T1=(273+20)K=293K。在高空的末状态时,各状态量分别为p2=0.7×105Pa,T2=(273-50)K=223K,则V2可以运用气态方程求出V2。
【解答】应用气态方程可以列出下式:
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\)
即
V2=\(\frac{{{p_1}{V_1}{T_2}}}{{{T_1}{p_2}}}\)=\(\frac{{1 \times {{10}^5} \times 8 \times 223}}{{0.7 \times {{10}^5} \times 293}}\)m3≈9.1m3。
这个计算结果告诉我们,压强虽减少,但体积并没有增大多少,因为温度降低对体积变化也有影响。
由上述示例可见,应用气态方程处理问题,要注意以下几个步骤:
1.明确研究对象是哪部分气体;
2.分析气体的初、末状态之间发生了什么变化,写出各状态量的值,找出未知量;
3.根据理想气体状态方程列式;
4.统一p、V、T各状态量的单位,且T的单位必须用热力学温标单位(K),然后代入数据,算出结果。
点击
活塞式发动机是利用汽油和空气混合后在密闭的容器(气缸)内燃烧、膨胀做功。气缸里的混合气体在“压缩冲程”里,混合气体的压强增大到10个大气压,温度增加到400℃左右,其体积减小到原来的\(\frac{1}{5}\)~\(\frac{1}{8}\)。压强、温度、体积三者变化规律遵循气态方程。
示例2
在容积为40L的容器中,盛有压缩二氧化碳3.96kg,如果该容器能承受的压强不超过6.0×106Pa,那么温度到达多少摄氏度时容器会有爆炸的危险?(已知二氧化碳在标准状态下的密度是1.98kg/m3)
【分析】容器内的气体在标准状态下的状态量分别是p1=1.0×105Pa,T1=273K,V1=\(\frac{m}{\rho }\)=\(\frac{{3.96}}{{1.98}}\)m3=2m3;气体到达爆炸点的状态量p2=6.0×106Pa,V2=40L=0.04m3,则可运用气态方程求出T2。
【解答】根据理想气体状态方程列式
\(\frac{{{p_1}{V_1}}}{{{T_1}}}\)=\(\frac{{{p_2}{V_2}}}{{{T_2}}}\)
T2=\(\frac{{{p_2}{V_2}{T_1}}}{{{p_1}{V_1}}}\)=\(\frac{{6.0 \times {{10}^6} \times 273 \times 0.04}}{{1.0 \times {{10}^5} \times 2}}\)≈328K=55℃。
由计算可知,容器温度必须控制在55℃以下,否则会引起爆炸。
【讨论】本题所给的条件中有密度这个物理量的值,若直接从密度的角度考虑,也可以解决问题。
假设标准状况下二氧化碳的密度为ρ1,容器将爆炸时气体的密度为ρ2,以始、末两状态时的体积V1=\(\frac{m}{{{\rho _1}}}\)、V2=\(\frac{m}{{{\rho _2}}}\),代入气态方程
\(\frac{{{p_1}m}}{{{\rho _1}{T_1}}}\)=\(\frac{{{p_2}m}}{{{\rho _2}{T_2}}}\)
可得到
\(\frac{{{p_1}}}{{{\rho _1}{T_1}}}\)=\(\frac{{{p_2}}}{{{\rho _2}{T_2}}}\)
应用这个关系式,就可以直接代入数据,求出末状态时的温度
T2=\(\frac{{6.0 \times {{10}^6} \times 273 \times 1.98}}{{1.0 \times {{10}^5} \times \frac{{3.96}}{{0.04}}}}\)K≈328K=55℃。
文件下载(已下载 318 次)发布时间:2016/2/22 下午2:02:07 阅读次数:2142
